例子问题
例子问题1:物理化学
热力学中哪一条定律说晶体的熵在绝对零度时等于0?
第一定律
第二定律
第零定律
第三定律
第三定律
热力学有四大定律:
热力学第零定律:如果两个独立的系统都与第三个独立的系统处于热力学平衡,那么前两个系统必然彼此处于热力学平衡。
热力学第一定律:能量既不会产生也不会消失。
热力学第二定律:宇宙的熵在每次反应后都会增加。
热力学第三定律:在0开尔文(绝对零度)的温度下,晶体的熵为0。
例子问题1:一般热力学
丙烷气燃烧的化学方程式如下:
给定下面的标准焓值,1摩尔丙烷燃烧的反应焓是多少?
已知反应物和生成物的摩尔焓值,我们可以用下面的公式求出反应的焓:
记住,摩尔焓值必须乘以平衡反应中的系数:
氧被省略了,因为它的焓值是零。
示例问题3:一般热力学
哪个不是吸热反应的特征?
冷的化学反应
净焓变是正的
释放能量到周围环境
从周围环境吸收能量
化学键的断裂
释放能量到周围环境
吸热反应以热的形式吸收能量。吸热反应涉及化学键的断裂,因为它涉及能量的吸收。吸热反应感觉很冷,因为它从你的皮肤上带走了热量。因为吸热反应涉及吸收能量,通常是以热的形式,所以焓变是正的。
因此,答案是“释放能量到周围环境”,这不是吸热过程的特征。相反,它是放热反应的一个特征,与吸热反应相反。
示例问题4:一般热力学
给定生成焓,辛烷值在反应中的燃烧焓是多少:
反应焓的方程为:
已知我们的化学反应和生成焓,我们就能求出反应焓。
首先,求生成物的总焓。
然后,求反应物的总焓。
因为氧是单质的,所以它的生成热是零。
回到原来的方程来计算最终的反应焓。
例子问题1:物理化学
下面哪个反应的熵变值是正的
水结冰成冰
盐从饱和的溶液中析出
水蒸发成水蒸气
水蒸发成水蒸气
熵是对系统无序程度的一种度量。换句话说,当一个系统的组成部分变得更加均匀和分散时,系统的熵就增加了。例如,当液体变成气体时,分子彼此分离,增加了系统的无序性。因此,水的蒸发导致熵的增加。
所有其他选项都会导致一个更有序的系统,从而减少熵。
例子问题2:一般热力学
在


我们可以用吉布自由能方程把焓、熵和吉布自由能联系起来:
记住温度必须是开尔文。因为我们知道反应的焓和吉布自由能,我们可以解出熵变:
示例问题7:一般热力学
下列哪个选项表明化学反应是不利的?
所有的这些
的标志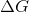



例子问题1:依数性
2M溶液的凝固点是多少
首先,我们需要计算质量摩尔浓度因为我们用它来计算凝固点的降低。我们可以从物质的量浓度中得到而不知道具体有多少升或多少克。我们只需要知道1mol / l。水的重量是1千克每升,所以我们可以做这个转换。
质量摩尔浓度是2m。范霍夫因子是3,因为在分解过程中每个分子得到一个钙离子和两个氯离子。
我们现在可以把这些值代入冰点降低的方程。
这就得到了


例子问题1:热力学和相
四升水中加入了多少氯化钠如果溶液的冰点是
氯化钠的摩尔质量是
我们可以用凝固点降低方程来确定在水中加了多少氯化钠。
水的正常冰点是0摄氏度,所以我们知道溶液的温度改变了2.5度。因为氯化钠在溶液中的每个分子会产生两个离子,所以范霍夫因子是2。根据水的密度,我们可以确定4升水重4千克。
示例问题3:依数性
在1kg的神秘溶剂中加入2mol氯化钠(NaCl)。NaCl的加入使溶剂沸点增加了6K。
根据这些信息,溶剂的沸腾常数是多少?
为了解决这个问题,我们可以用沸点升高方程:
我们知道温度的变化,我们可以根据已知的信息计算质量摩尔浓度,我们还知道范霍夫因子(在这种情况下,由于NaCl在溶液中变成2个离子,预计是2)。我们可以计算溶剂的沸点常数。









































































