例子问题
例子问题1:溶解度
磷酸二铁的解离公式是什么?
铁(II)带两个正电荷:
磷酸盐带三个负电荷:
初始化合物的构造必须抵消这些电荷。分离是:
例子问题1:溶解度
Pb(哦)2有一个Ksp是1.43 * 10-20年.
它的溶解度是多少?
2.43 * 107米
8.42 * 10-12年米
1.53 * 107米
1.20 * 10-10米
1.53 * 107米
氢氧化铅按以下反应解离:
Ksp= (Pb2 +][哦-]2
如果(Pb2 += x,那么[OH .-] = 2 x。它们以1:2的比例存在。
Ksp= 1.43 * 10-20年x = x (2)2x = 43.
X = 1.53 X 107米
例子问题1:溶解度
以下哪个因素通常会导致溶质更容易溶解到溶液中(即增加溶解度)?
提高溶液的温度
降低溶液的温度
这些选择都不会增加溶解度
共离子效应
提高溶液的温度
提高溶液的温度通常会增加其溶解度,而降低温度则会产生相反的效果。普通离子效应指的是当溶液中的两种化合物分离产生至少一个相似的离子时的现象,这将使溶液中额外数量的离子更难分离,从而降低溶解度。
例子问题1:溶解度
如果Ksp其中解离为2.70 * 104, NaCl的溶解度是多少?
7.29 * 108米
1.89 * 10-2米
1.64 * 10-2米
1.44 * 10-2米
1.64 * 10-2米
首先,建立一个平衡的反应,然后进入X每一种溶质被溶解的量。随着NaCl的分解,每个离子的数量都会增加一定数量,X.
然后建立K值的方程sp并输入值X对于每一个溶质。用这个方程来解X,溶解度(mol/L)。记住,方程中不包括NaCl,因为它是纯固体。
示例问题4:溶解度
如果CaF的溶解度2在上述解离反应中测定为1.54 * 103M, K是多少sp值CaF2?
2.24 * 106
1.98 * 108
1.42 * 106
1.46 * 108
1.46 * 108
用解离的平衡反应来赋值X求每个离子的溶解度。作为CaF2解离时,每个离子的量会增加一定的量;钙离子会增加X氟离子会增加2X.
然后代入方程来解Ksp,使用X为每个溶质赋值。用给定的溶解度值来求Ksp.记住,方程中不包括NaCl,因为它是纯固体。
问题41:分析化学
考虑以下氢氧化钡在水溶液中的溶解度平衡方程。
氢氧化钡的溶解度是多少?
为了求出氢氧化钡的溶解度,我们需要建立反应的ICE表。
一、开始时,溶液中没有钡离子和氢氧根离子,所以我们可以称它们的浓度为零。
C.对于每个溶解的氢氧化钡分子,会有一个钡离子和两个氢氧化钡离子。因此,每个离子的增加可以指定

E.最后,我们将这些值代入平衡表达式,并使其等于溶解度积常数。
例子问题1:溶解度
将四种不同的不溶盐等量地加入水溶液中。假设盐之间不以任何方式相互作用。下表列出了盐类及其溶解度积常数。
下列哪种离子在溶液中浓度最高?
溶解度积常数帮助我们想象哪些离子在溶解到平衡态后浓度最大。
在…的溶解上

例子问题1:溶解度
考虑以下氢氧化钡在水溶液中的解离平衡方程。
在溶液中加入1M的硝酸钡溶液。氢氧化钡加入后的溶解度是多少?
在我们解出溶解度之前,记住勒夏特列原理。硝酸钡是一种可溶的盐,它会完全溶解在溶液中。这意味着在盐溶解之前会有1mol / l浓度的钡离子。因为我们加入了反应的生成物,我们可以预测平衡会向左移动,氢氧化钡的可溶性会降低。这种平衡的变化称为共离子效应。
我们将使用ICE表来测定盐的溶解度。
一、在盐开始溶解之前,溶液中有一摩尔浓度的钡离子(来自硝酸钡),没有氢氧根离子。
C.由于每个溶解的氢氧化钡分子会产生一个钡离子和两个氢氧根离子,每个离子的未知增量可以指定

E.现在,我们设溶解度表达式等于溶解度积常数。
因为1比我们得到的值要大得多
不存在离子效应的氢氧化钡的溶解度为0.108M。注意盐的溶解度是如何降低的,正如勒夏特列原理一开始预测的那样。
例子问题2:溶解度
化学家有一个完全饱和的X化学溶液,固体X在底部。如果她加入一种能和水X反应的化学物质,固体会发生什么变化?
更多的固体会从溶液中析出
一层沉积物将覆盖在固体上
固体会改变颜色
不会发生任何改变
它会开始溶解在溶液中
它会开始溶解在溶液中
完全饱和的溶液处于固相和水相之间的平衡状态,但这是一个动态平衡。当反应的化学物质与X水溶液发生反应时,越来越多的固体溶解在溶液中。
示例问题163:物质的解和状态
任意气体的分压,
亨利定律常数

它的溶解度是多少
没有可用的答案
亨利定律可以表示为:
在哪里
















![K_{sp}= [Na^{+}][Cl^{-}] = (X)(X) = X^{2}](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/85510/gif.latex)










![K_{sp}= [Ca^{2+}][F^-]^2=(X)(2X)^{2} = 4X^{3}](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/119041/gif.latex)








![K_{sp}=[Ba^{2+}][OH^-]^2](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/94058/gif.latex)
![\small 5*10^{-3} = [x][2x]^{2}](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/126927/gif.latex)







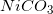




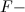

![[F^-]<[CrO_4^{2-}]](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/119420/gif.latex)








![K_{sp}=[Ba^{2+}][OH^-]^2](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/110662/gif.latex)
![\small 5*10^{-3} = [1+x][2x]^{2}](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/94077/gif.latex)
![\small 5*10^{-3} = [1][2x]^{2}](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/94078/gif.latex)










