例子问题
例子问题1:酸碱平衡与滴定
用0.2M氢氧化钠溶液滴定50mL 0.2M盐酸溶液。加入48mL氢氧化钠溶液后溶液的pH值是多少?
由于强酸与强碱滴定,我们可以简单地用原来的酸的摩尔数减去加入的碱的摩尔数。
用同样的方程,我们发现加入了0.0096摩尔的氢氧化钠。
从盐酸中减去这个量,就得到0.0004摩尔的酸。
记住,我们必须用这个摩尔量除以新卷,在基数添加之后。
因为这是强酸,我们可以简单地取这个浓度的负对数,就得到pH值为2.39。
例子问题1:酸碱平衡与滴定
用0.2M氢氧化钠溶液滴定50mL 0.2M盐酸溶液。加入50mL的氢氧化钠后pH值是多少?
当酸的摩尔量等于碱的摩尔量时,溶液就达到了所谓的等当点。当强酸与强碱滴定时,例如在这个例子中,这两种试剂会完全中和对方。因为酸的共轭碱非常弱,它不会影响pH值。因此,等当点的pH值为7.00。
例子问题2:酸碱平衡与滴定
50mL 0.2M氢氟酸溶液用0.2M氢氧化钠溶液滴定。加入20mL碱后溶液的pH值是多少?
由于氢氟酸是弱酸,我们需要考虑碱中和酸时产生了多少共轭碱。我们可以从确定一开始有多少摩尔酸开始。
用同样的方程,我们发现只加入了0.004摩尔的碱。
当酸碱相互抵消后,就剩下0.006摩尔的酸和0.004摩尔的共轭碱。这是基于中和方程:
(为了简单起见,旁观者钠离子被省略了,尽管它是存在的)。
现在我们知道了酸和共轭碱的量,我们可以用Henderson-Hasselbalch方程来求解pH。
例子问题1:酸碱平衡与滴定
50mL 0.2M氢氟酸溶液用0.2M氢氧化钠溶液滴定。加入50mL的氢氧化钠溶液的pH值是多少?
这个问题不像假设pH值是7那么简单因为酸和碱的量是相等的。原因是,虽然酸碱已经相互中和,但仍然存在氟离子作为共轭碱的问题。这个反应的方程是:
(钠离子被省略了,因为它只是一个旁观离子)。
通过将酸碱的量换算成摩尔,我们可以发现每一种都加入了0.01摩尔,在这个过程中相互中和。根据方程,还剩下0.01摩尔的氟离子。为了求出浓度,我们只需将其除以所有碱都加进去后的新体积:
接下来,我们可以用这个方程来确定氟离子的碱解离常数
最后,我们使用ICE表来确定溶液中的氢氧根浓度。
氟离子浓度会降低

利用pH方程,我们确定体系的新pH值为8.07。
例5:酸碱平衡与滴定
50mL 0.2M氢氟酸溶液用0.2M氢氧化钠溶液滴定。加入60mL碱后溶液的pH值是多少?
由于现在溶液中的强碱比弱酸多,因此仅强碱的剩余量就决定了pH值。
通过将浓度换算为摩尔,我们可以确定一开始是0.01摩尔的弱酸。
用同样的方程,我们可以确定加入了0.012摩尔的碱。
中和之后,剩下0.002摩尔的强碱。这个强碱是我们用来确定ph值的唯一值。由于最终体积为110mL,剩余氢氧化钠的浓度计算为
最后,我们可以先求出pOH,然后从14减去pH。
例子问题1:酸碱平衡与滴定
研究人员准备了两种溶液。在溶液A中,他加入了等体积的

两种溶液的盐浓度相等
溶液B的盐浓度更高
不知道溶液的体积就不能确定
溶液A的盐浓度更高
溶液A的盐浓度更高
一般的酸碱反应包括盐和水的生成。生成物的数量取决于反应物的强度。回想一下,强酸完全解离成氢离子并与碱在水中结合。同样,强碱在水中完全解离成共轭酸和氢氧根离子。一份盐(像




溶液B也会形成盐;然而,由于乙酸是弱酸,只会产生少量的共轭碱(乙酸)分子,从而减少了盐的产量。
例子问题2:酸碱平衡与滴定
关于酸碱平衡,下列哪一项是正确的?
一、弱酸/强碱溶液的pH值高于弱酸/弱碱溶液
2酸的pKa决定了溶液中产生多少氢离子
3强酸/强碱溶液的氢氧根离子浓度为
I和II
我
II及III
I, II,和III
I, II,和III
pH值是衡量溶液中氢离子浓度的指标。pH值越高,氢离子浓度越低,pH值越低,氢离子浓度越高。回想一下,强碱完全解离成共轭酸和氢氧根离子而弱酸不能完全解离成共轭碱和氢离子。由于弱酸/强碱溶液中有过量的氢氧根离子,氢氧根离子将与弱酸中的氢离子反应并消耗掉。这将降低氢离子的浓度,从而增加ph值。另一方面,弱碱不会产生那么多氢氧根离子;因此,不会消耗那么多的氢离子(pH值会降低)。
pKa是酸强度的量度。pKa越低,酸性越强。酸解离成氢离子和共轭碱的程度取决于强度;因此,pKa决定了产生多少氢离子。
强酸和强碱会完全解离成它们各自的共轭物。这意味着,如果加入等量的强酸和强碱,就会产生等量的氢离子和氢氧根离子。由于它们的数量相等,氢离子和氢氧根离子会相互反应生成水。回想一下,水的pH值是7;因此,强酸/强碱溶液的pH值始终为7(如果加入等量的强酸和强碱)。pH值的定义为:
如果我们解出氢离子浓度:
因此,强酸/强碱溶液中的氢离子浓度为:
氢离子浓度与氢氧根离子浓度的关系为:
如果我们解![[OH^-]](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/516450/gif.latex)
例子问题2:酸碱平衡与滴定
在滴定过程中,可以观察到缓冲区发生在
溶液中含有醋酸和氨
这种溶液是由盐酸和醋酸组成的
溶液中含有盐酸和氨
溶液中含有强碱
溶液中含有强碱
当溶液的pH值等于酸的pKa时,缓冲区就出现了。这意味着酸的pKa是4;因此,这种酸是弱酸。回想一下,当弱组分(酸或碱)加入强组分(酸或碱)时,在滴定过程中会出现缓冲区。例如,当弱酸加入强碱时,可以看到缓冲区域。既然我们已经确定酸是弱酸,那么溶液中的另一个组分一定是强碱。注意,用两种强试剂(强酸和强碱)滴定不会产生缓冲区。
问题9:酸碱平衡与滴定
与弱酸-强碱滴定法相比,强酸-强碱滴定法具有__________等当点的pH值和a__________端点的pH值。
更高……较低的
更低……更高的
更高……更高的
更低……较低的
更低……较低的
等当点是添加的酸或碱的量与对应的酸或碱的量相等的那一点。在强酸-强碱滴定中,等当点发生在pH = 7时。在弱酸-强碱滴定中,等当点发生在较高的ph点。这是因为在等当点所有的弱酸都转化为共轭碱,增加了氢氧根离子的浓度。终点是滴定的终点。这通常发生在等当点;因此,强酸-强碱滴定法在终点的pH值较低。











![pH = -log[H^{+}] = -log[0.0041] = 2.39](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/260338/gif.latex)






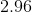





![pH = pK_a + log\frac{[A^{-}]}{[HA]} = -log[7.2*10^{-4}] + log\frac{0.004}{0.006} = 2.96](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/260350/gif.latex)



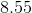







![x = 1.17*10^{-6}M=[OH^-]](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/260361/gif.latex)
![pH=14-pOH=14-(-log[OH^-])](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/260362/gif.latex)








![pOH = -log[OH^{-}] = -log[0.018] = 1.74](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/260371/gif.latex)


![pH = -log[H^+]](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/516446/gif.latex)
![[H^+] = 10^-^p^H](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/516447/gif.latex)
![[H^+] = 10^-^7M](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/516448/gif.latex)
![[H^+][OH^-] = 10^-^1^4](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/516449/gif.latex)
![[OH^-] = \frac{10^-^1^4}{[H^+]}](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/516451/gif.latex)
![[OH^-] = \frac{10^-^1^4}{10^-^7} = 10^-^7M](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/516452/gif.latex)



