例子问题
示例问题11:大学化学
给定下面的反应图,下列哪项用红色箭头标出?

可能的答案:
逆反应的活化能
正向反应的活化能
焓变
熵变
正确答案:
正向反应的活化能
解释:
完全填充的反应坐标图如下图所示。

题中箭头表示活化能,活化能是反应物生成生成物必须克服的能垒。
这个反应也是放热的,因为生成物的能量比反应物的能量低。
例子问题1:反应坐标图
如果


可能的答案:
反向活化能无法确定。
正确答案:
解释:
首先画出反应坐标图并贴上标签。
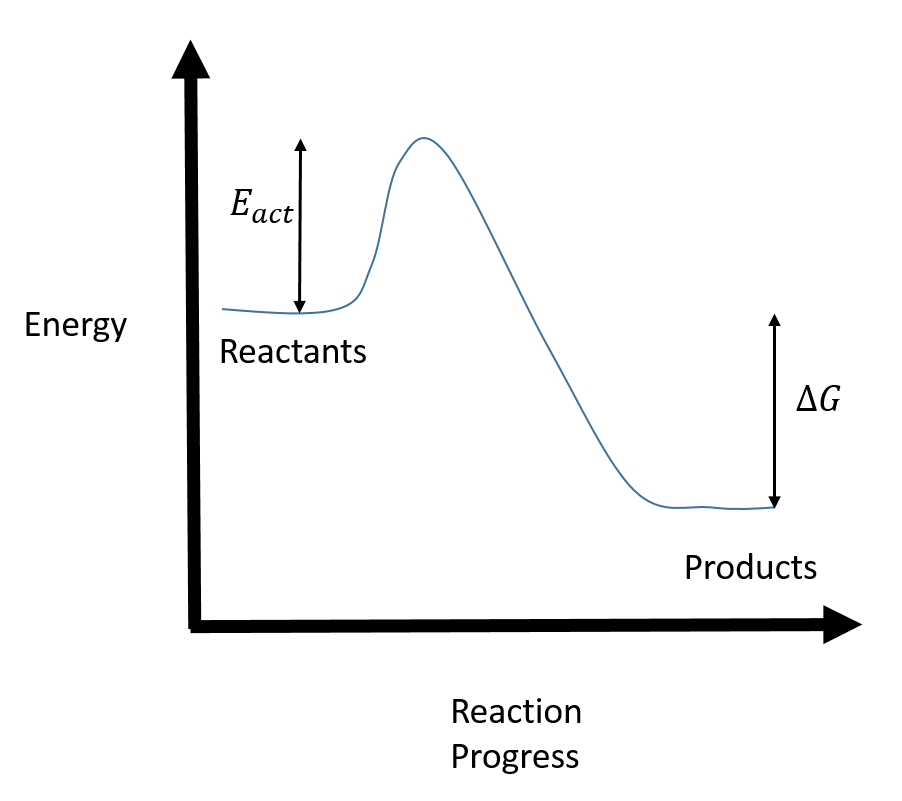
因为我们知道
现在,题目想让你求出反应的活化能。换句话说,我们想从生成物开始,以反应物结束。从图中可以看出,逆向活化能就是正向反应的活化能和
示例问题13:大学化学

假设标准条件,根据所示的自由能图,下列哪个说法是正确的?
可能的答案:
生成物的熵大于反应物的熵
生成物的熵小于反应物的熵
这个反应的平衡常数小于1
这个反应的平衡常数大于1
正确答案:
这个反应的平衡常数小于1
解释:
在这个问题中,我们得到了一个在标准条件下发生的化学反应的自由能图。我们被要求找出一个关于这个图表的正确表述。
我们马上就能看到生成物的自由能大于反应物的自由能。因此,这个反应的自由能变化为正,所以它是一个内生反应。回想一下,自由能变化值的表达式如下。
从这个方程可以看出,平衡常数与自由能的标准变化有关。并且,我们可以看到,如果标准自由能变化为正,则的值

另外,我们不能根据图来判断熵是增加还是减少。这是因为熵不是决定反应自由能变化的唯一因素。焓的变化也是必须考虑的一个因素。
受欢迎的科目
休斯顿的西班牙语家教,西雅图的生物导师,旧金山湾区的法语导师,费城的化学导师,波士顿的GMAT导师,休斯顿的SAT辅导老师,旧金山湾区的阅读导师,洛杉矶的统计学导师,凤凰城的微积分老师,凤凰城的LSAT导师










