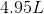例子问题
例子问题1:化学计量学的反应
考虑小苏打和醋在水溶液中的反应:
如果我们从17g开始

假设所有气体在大气压下都表现为理想气体。温度为298K。
我们从17克

现在根据分子量,我们将计算17g以内的摩尔数
现在我们将用它来计算产生的气体的摩尔数。在这个反应中,唯一产生的气体是二氧化碳。
1个大气压、298 K的理想气体的摩尔体积为
例子问题2:化学计量学的反应
中和15mL 1.0M亚硝酸需要多大体积的0.5M NaOH ?
30升
1 l
10毫升
30毫升
30毫升
酸和碱都提供了等价的必要离子(分别是H+和OH -),因此你可以使用方程M1V1 = M2V2。
(1) (15) = (0.5) V2
V2 = 30毫升
例子问题3:化学计量学的反应
0.5M Mg(OH)的体积是多少2有必要中和15mL 1.0M的亚硝酸吗?
15毫升
10毫升
1 l
30毫升
15 l
30毫升
这个问题很棘手,因为你必须意识到Mg(OH)2会释放2个OH -分子,每当其中一个溶解;因此,你只需要一半的Mg(OH)2中和所有的亚硝酸,只有相当于1的量。
M1V1 = M2V2
代入数值,你得到30mL,但实际上你只需要这个量的一半。
例子问题1:化学计量学的反应
镁会与氧气结合,根据下面的配平方程式生成氧化镁。
如果反应中产生了65g MgO,那么反应中使用了多少克镁?
为了确定反应中使用了多少克镁,我们可以用MgO中镁的质量百分比来计算出65克MgO中镁的含量。MgO的摩尔质量是40.3克。镁的摩尔质量是24.3克。用24.3除以40.3可以看出,镁占MgO质量的60%。
用65克乘以0.603得出,65克MgO中含有39.2克镁。
解决这个问题的另一种方法是将MgO的克换算成摩尔。在给定的化学方程中,MgO与Mg的比值为2:2,因此形成的MgO的摩尔数等于反应出的Mg的摩尔数。一旦找到这个数,就可以用镁的摩尔质量将其转换回克。
例子问题5:化学计量学的反应
考虑下面的化学反应:
多少摩尔的
没有可用的答案
没有足够的信息来回答这个问题
1.56摩尔
4.17摩尔
1.39摩尔
1.39摩尔
这个问题是基于化学计量学来解决的。利用给定反应中的分子量和比例,我们可以解出的量
例子问题6:化学计量学的反应
氨的形成由下式给出:
假设你从20g氢气开始,那么需要多少氮气才能使氢气发生反应?
6.67克
40克
60克
93.33克
93.33克
我们可以用摩尔=质量/摩尔质量方程式将氢的质量从克转换为摩尔
现在我们有了氢的摩尔数,我们可以用1:3方程中给出的摩尔比。因为我们需要1/3摩尔的氢作为氮,我们知道我们需要3.33摩尔的氮气。
现在,我们简单地用摩尔数乘以氮气的摩尔质量(每摩尔28克),我们发现我们需要93.33克氮气。
例子问题7:化学计量学的反应
氨的形成由下式给出:
假设你从15mol氢气开始,那么需要多少mol氮气才能使氢气完全反应?
由于氢气的量是以摩尔为单位给出的,这个解就像用反应物之间的摩尔比一样简单。看这个方程,我们发现氮气和氢气的比例是1:3。因此,我们需要三分之一的氢气才能用完所有的氢气。
例子问题1:化学计量学的反应
当5.00克氢气与多余的氧气反应时,会形成多少摩尔的水蒸气?
在处理与化学计量学相关的问题时,只比较摩尔比是很重要的。
氢气是双原子的。当把克换算成摩尔时,我们需要把氢的相对原子质量翻倍。
我们现在知道我们有2.5摩尔的氢气。现在我们需要写一个配平的方程来确定氢气和生成物之间的转换系数。
每消耗两摩尔氢,就会产生两摩尔水。利用这个比例和初始氢的物质的量,我们可以计算出产生的水的物质的量。
示例问题42:化学计量学
氯气的体积有多大啊
没有足够的信息来回答这个问题
首先,我们需要解出与全量金属钠反应所需的氯气的摩尔数。
现在,利用理想气体定律,我们可以解出在给定的温度和压力下,这种气体所占的体积。