例子问题
例子问题1:氧化还原反应原理
甲烷在氧气存在下燃烧,反应如下:
关于反应,下列哪个陈述是正确的?

氧的电荷是
碳在反应中被氧化
氧在反应中被氧化
碳的初始氧化态是
碳在反应中被氧化
通过比较作为反应物的原子的氧化数和作为产物的原子的氧化数,我们可以确定原子是否被氧化或还原。氧化数的增加表示电子的损失或氧化。氧化数的减少表明电子的增加或减少。
对于电化学,你们应该熟悉氢的传统氧化态



碳最初以甲烷的形式存在,这意味着它连着四个氢原子。分子是中性的,每个氢的氧化值是

在a产物中,碳连着两个氧,每个氧都带一个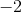

因为碳的氧化态
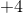
例子问题2:氧化还原反应原理
下列哪个反应涉及电子的转移?
氧化还原
分解
结合
中和
氧化还原
当一种物质被氧化——失去电子——另一种物质被还原——获得电子时,就会发生氧化还原反应。因此,这是已知选项中唯一涉及电子转移的选项。
例子问题3:氧化还原反应原理
关于这个反应,哪个说法是错误的?
铬是这个反应的氧化剂。
铝在反应过程中被氧化。
铬在反应中被氧化
这个反应是单位移反应的一个例子。
铬在反应中被氧化
在Cr2O3.Cr带+3的电荷。金属铬是中性的,因此带0电荷。Cr从+3还原为0。
记住,OIL RIG。氧化是电子的损失,还原是电子的获得。
问题4:氧化还原反应原理
考虑一下下面的反应:
下面哪个陈述是正确的?
锌被还原,铜被氧化
硫被还原,铜被还原
锌被氧化,铜被还原
硫被氧化,铜被还原
锌被氧化,铜被还原
对于任何氧化还原反应,被氧化的原子将失去电子,而被还原的原子将获得电子。锌最初是单质的,所以它的初始氧化态为零。作为产物,它有电荷
铜最初的氧化态是
硫留在硫酸络合物离子中,保持其整体
例子问题1:氧化还原反应原理
在这个反应中,电子从___________来___________.
钙……氢
氢……钙
钙……氯
氯……氢
氢……氯
钙……氢
电子的转移表示氧化还原反应。失去电子的元素被氧化,而得到电子的元素被还原。
钙最初是中性固体,但作为产物有电荷
氢一开始带电荷
因此,我们可以得出结论,钙被氧化,氢被还原,表明电子从钙转移到氢。
氯的电荷仍然存在
例子问题1:氧化还原反应原理
在接下来的反应中,哪种化合物被氧化了?
氢
硝酸
铜
没有氧化作用
硫
硫
氢不变。铜2 +不变(与S合作)2 -然后是SO42 -).硫从S2 -和S6 +(搭配6 O2 -带2电荷),表示氧化。氮从N5 +到N2 +这意味着它被还原了。
示例问题7:氧化还原反应原理
考虑一下下面的反应:
什么是氧化剂,什么是还原剂?
银是氧化剂,铜是还原剂
没有发生氧化还原化学反应
银是还原剂,没有氧化剂
银是还原剂,铜是氧化剂
银是氧化剂,没有还原剂
银是氧化剂,铜是还原剂
让我们把这个反应分解成两个独立的反应:

我们可以看到铜失去电子,而银得到电子。回想一下,就电子而言,氧化是损失,还原是得到。铜被氧化,银被还原。
然而,这个问题要求氧化剂而且还原剂.回想一下,氧化剂被还原,还原剂被氧化。因为铜是氧化的,所以它是还原剂。同样地,因为银被还原了,所以它是氧化剂。
例子问题1:氧化还原反应原理
氧化是什么意思?
质子增益
中子损失
电子的损失
电子的获得
质子损失
电子的损失
想想“OIL RIG”,氧化是失去电子,还原是获得电子。电子的得失改变了原子或分子的电荷。在氧化还原反应中,电子被转移。改变质子数会改变元素的性质,但事实并非如此。因为化学反应涉及到价电子,所以原子核是不变的。
问题9:氧化还原反应原理
关于反应方程,哪个表述是正确的?


这是一个燃烧反应
这是一个水解反应






例子问题10:氧化还原反应原理
卵菌属疫霉能够通过破坏农作物造成经济损失。这个名字Phytopthora源自希腊语phyton =植物,phthora =破坏,字面意思是植物破坏者。然而,化学家们可能会与它们的破坏性影响作斗争。
化合物名为碳酸铜(II),可用于破坏植物破坏者,其产量如下式所示:
生成碳酸铜的反应的净离子方程是什么?
离子方程是一个化学方程,其中水溶液中的离子化合物被写成解离离子。
一个完整的离子方程显示了溶液中存在的所有离子(包括反应性离子和观察性离子),作为解离离子。本题反应的完整离子方程为:
值得注意的是,在一个完整的离子方程中,很容易看出哪些离子参与了氧化还原反应,哪些离子是旁观者离子(在反应过程中不发生变化的离子)。例如,自从




净离子方程只显示了溶液中的活性离子和由它们形成的产物。因此,纯离子方程可以简单地通过观察完整的离子方程,并省略观察离子,如下所示:
净离子方程:





















