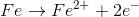例子问题
例子问题1:反应类型
庚烷燃烧时的配平方程式是什么?
2摄氏度7H14+ 5啊2→3 H2O + 6 co2
C7H16+ 11 O2→8 H2O + 7 co2
C5H12+ 8点2→6小时2O + 5 co2
C7H16+ O2→H2O +有限公司2
C3.H8+ 5啊2→4 H2O + 3 co2
C7H16+ 11 O2→8 H2O + 7 co2
庚烷:C7H16.燃烧是指分子与O发生反应2产品是CO2和H2o平衡得到7 CO28 H21个庚烷,11个庚烷2
例子问题2:反应类型
下列哪个反应的放热最多?
碳氢化合物链越长,产生的燃烧产物(CO2和H20)越多。像异丙烷和异丁烷这样的支链分子比直链分子更难燃烧。
示例问题3:反应类型
下面哪个条件可以描述燃烧反应?
放热带阳性
吸热带正电荷
放热带负电
Exergonic with a positive
阴阴带负号
放热带负电
放热反应会有一个负电荷

燃烧反应释放热量;因此它一定有一个负号
火能反应是阴性的
例子问题1:氧化还原反应
在酸性溶液中发生以下氧化还原反应:
菲2 ++ Cr2O72 -→铁3 ++ Cr3 +
这个氧化还原反应的系数和是多少?
35
33
36
34
37
36
当你在酸性条件下平衡氧化还原反应时,有6Fe2 +、1铬2O72 -14 H+6菲3 +2 Cr3 +,和7h2O.别忘了在Cr前面加12O72 -
例子问题1:平衡氧化还原反应
对于下面的不平衡氧化还原反应,有多少电子被转移,哪些化学物质被氧化?
一个电子被转移;P是氧化
两个电子被转移;Hg被氧化
一个电子被转移;Hg被氧化
两个电子被转移;P是氧化
两个电子被转移;Hg被氧化
首先,我们需要通过识别氧化值的变化,将给定的反应分为两个半反应。在这种情况下,汞(Hg)和磷(P)显示出氧化值的变化。水银的氧化值开始是0,结束时是



现在我们可以开始看半反应了。
平衡原子。
现在平衡电子。我们知道每个汞原子失去一个电子,每个氟原子得到一个电子。
我们可以看到两个电子转移了。为了确定被氧化的元素,我们必须找到失去电子的元素。在这种情况下,汞被氧化了。
例子问题1:平衡氧化还原反应
有多少电子参与了下面的反应?
3 e-
5 e-
2 e-
4 e-
1 e-
5 e-
1e之间的公因数-和5 e-是5。因此所涉及的电子数是5e-.
例子问题2:平衡氧化还原反应
有多少电子参与了下面的反应?
10 e-
2 e-
5 e-
4 e-
1 e-
10 e-
2e之间的公因数-和5 e-是10。因此所涉及的电子数是10e-.
示例问题4:平衡氧化还原反应
OH的平衡系数是多少-对于以下反应:

1
5
2
3.
4
2
把它们相加:
简化:
在每一面加入氢氧化物来对抗H+.
简化:
示例问题5:平衡氧化还原反应
下面反应中所有平衡系数的和是多少:

10
12
8
16
14
14
把这些方程加起来
简化
加上2哦-把两边的H消掉+.
简化:
例子问题1:一半的反应
对于所示的氧化还原反应,下面哪个半反应发生在阳极?
回想一下,氧化总是发生在阳极(在电化学电池和原电池中)。