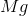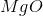例子问题
例子问题1:焓
关于化学反应,下列哪个说法是正确的?
催化剂降低了反应的焓变
吸热反应的活化能比放热反应低
的

放热反应总是自发的
的

当一个化学反应用图形表示时,我们看到正向反应和逆向反应之间的焓变是相反的。如果一个反应在正向过程中产生能量,它就需要在逆向过程中输入能量,反之亦然。
催化剂只影响化学反应的速率;它不影响平衡。最后,放热反应并不总是自发的,但与吸热反应相比,放热反应的活化能较低。
例子问题2:焓
下面这个反应的焓变是多少?
焓变的计算公式为:
当
在进行计算之前,首先平衡反应是很重要的。这些系数对于确定反应的焓变是很重要的。
示例问题3:焓
二氧化氮的形成是一个两步过程。
净反应是
生成4mol二氧化氮时焓变是多少?
赫斯定律指出,整个反应的焓变等于反应中每一步的焓变之和。换句话说,我们可以通过把二氧化氮形成的两个步骤的焓变相加来确定它的焓变。
这就得到了反应物的总焓变,
例子问题1:焓
计算ΔH得到以下反应:
CH4 (g)+ O2(g)⇌有限公司2 (g)+ H2O(左)
复合ΔH
CH4(g) -74.8焦每摩尔
H2O (l) -285.8 kJ/mol
有限公司2(g) -393.5焦每摩尔
-604.5焦每摩尔
604.5焦每摩尔
没有足够的信息
889.7焦每摩尔
-890.3焦每摩尔
-890.3焦每摩尔
ΔH = Σ ΔHf products - Σ ΔHf反应物
Δ高频O2或者任何元素都是0
第一步是平衡等式:
CH4 (g)+ O2(g)⇌有限公司2 (g)+ 2 h2O(左)
ΔH = Σ ΔHf products - Σ ΔHf反应物
=[-393.5焦每摩尔+ 2(-285.8)焦每摩尔)-(-74.8焦每摩尔)
= -890.3焦每摩尔
示例问题5:焓
给定反应的焓变是多少?
焓变的计算公式为:
当
既然反应的顺序是正确的,把所有的

例子问题1:焓
下面这个反应的焓变是多少?
焓变的计算公式为:
当
在进行计算之前,首先平衡反应是很重要的。这些系数对于确定反应的焓变是很重要的。
示例问题7:焓
下面这个反应的焓是多少?
焓变的计算公式为:
当
在进行计算之前,首先平衡反应是很重要的。这些系数对于确定反应的焓变是很重要的。对于这个特殊的反应,因为有两摩尔生成物,生成焓
示例问题8:焓
下面这个反应的焓变是多少?
焓变的计算公式为:
当
在进行计算之前,首先平衡反应是很重要的。这些系数对于确定反应的焓变是很重要的。
例子问题1:焓
下面这个反应的焓变是多少?
焓变的计算公式为:
当
在进行计算之前,首先平衡反应是很重要的。这些系数对于确定反应的焓变是很重要的。
示例问题10:焓
考虑以下燃烧反应:
下表是化合物的生成焓:
如果燃烧了1mol丙烷,反应的焓是多少?
既然有了生成焓,我们可以用下面的公式求出反应的焓:
我们需要用配平方程的系数来计算焓。
由于氧气是单质的,它没有生成焓,因此从方程中省略了。