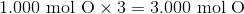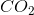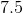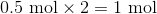例子问题
例子问题1:化学计量学
香兰素是由


香兰素的实验式是什么?
各元素的原子质量见下表:
为了根据给定的百分比组成数据计算香兰素的经验公式,我们可以假设我们有一个100g的样品香兰素,并从那里估计每种元素组成样品的多少克。例如,香兰素
在求出假设100g样本中每种元素的摩尔数后,我们通过将所有样本除以最小摩尔数来计算每种元素的摩尔数之比。在求出样品的比值后,我们可以使用香兰素的经验公式,对每个样品进行四舍五入到最接近的整数。如果这些比率不够接近,不能四舍五入(就像这个例子一样),我们将这些比率都乘以相同的数字,直到每个数字都等于一个整数。计算如下:
我们需要整数,所以每个结果数乘以3来去掉分数。
这给了我们
例子问题1:化学计量学
哪一对公式代表了某种化合物的分子式和分子式?
为求经验公式,取一个分子式,将每个元素的下标除以所有下标的最大公因数。在这种情况下,唯一有效的配对是
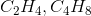

例子问题1:化学计量学
有分子式的庚烷中碳的质量百分比大概是多少
首先,计算庚烷的摩尔质量
我们可以计算出庚烷中碳的质量百分比,方法是将碳的质量除以整个分子的质量,并将其转化为一个百分比:
每100克庚烷中,有84克必须来自碳。这意味着碳的质量百分比是
例子问题1:阿伏伽德罗常数
一摩尔有多少个硝酸盐
注意有两个硝酸盐(
例子问题1:化学计量学
一摩尔有多少个氢原子
在一个分子中

例子问题1:化学计量学
计算铝离子的数量

为了计算铝离子的数量,我们必须首先找出整个化合物中铝离子的数量。在这种情况下,有两个分子

例子问题1:化学计量学
在0.2550克氯化铝中有多少氯原子,
氯化铝的分子式是





总分子量为130.33 g。从克开始


例子问题1:化学计量学
当下面所示的反应方程用最小的整数系数平衡时,反应物系数的和是多少?
___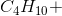


这个方程的系数配平后应该是2、13、10和8。这个问题要求的是反应物,所以只需要加入反应物左边的系数。2和13的和是15,所以15是正确答案。
示例问题21:Sat化学科目测试
假设8克氢气和16克氧气被点燃。水的理论产量是多少,单位是克?假设氢的相对原子质量是1,氧的相对原子质量是16。
首先,用化合物的摩尔质量将克转换为摩尔。有4mol氢气和0.5 mol氧气。氧气显然是限制试剂(因为氢气是氧气的两倍多),这意味着水的理论产率为
水含有两个氢原子和一个氧原子,所以它的摩尔质量是
因此,1mol水的质量是18g。
例子问题1:化学计量学
辛烷,
如果在如下所示的完全燃烧反应中燃烧114克辛烷值,将会产生多少克水?
___


首先,等式要配平。这可以用系数2,25,16和18来完成。
接下来,计算辛烷的摩尔质量,结果表明它的摩尔质量为114克/摩尔。这意味着在反应中使用了1mol的辛烷值,并产生了9倍的水,这意味着一个产物将是9 mol的水。水的摩尔质量是18g /mol,所以产生的水的总质量是