示例问题
问题1:气体
研究人员将一个封闭的活塞容器置于室温下。他把一个本生灯放在容器的底部,观察到活塞向上移动。什么能最好地解释这种现象?
由于博伊尔的法律,气体的压力下降
由于查尔斯定律,气体的压力降低了
由于波义耳定律,气体的体积增加了
由于查尔斯定律,气体的体积增加了
由于查尔斯定律,气体的体积增加了
主要有三个气体定律。阿伏伽德罗定律指出气体的摩尔数与体积成正比(在恒定的压力和温度下)。波义耳定律指出气体的压力与体积成反比(在恒定的摩尔数和温度下)。这意味着当体积增加时,压力按比例减小。查理定律指出温度与体积成正比(在一定的摩尔和压力下)。问题说明活塞向上运动。这意味着气体的体积在内部膨胀,推动活塞向上,为膨胀的气体腾出空间。气体膨胀是由于温度升高而发生的(查理定律)。
问题1:气体定律
在恒定温度和摩尔中,关于气体的压力和体积,以下哪项是真的?
压力和体积具有与负相关的指数关系
压力和体积是相互独立的
压力与体积呈线性正相关关系
压力和体积具有与正相关的指数关系
压力与体积呈线性正相关关系
首先,我们需要弄清楚哪个气体定律在这里适用。问题说温度和摩尔数是恒定的。这意味着我们在处理波义耳定律,即压强与体积成反比。反比意味着压强随着体积的增加而减小,反之亦然。注意,关系仍然是线性的(一个变量的变化导致另一个变量的比例变化),但两个变量有负相关。正相关意味着增加或减少一个变量也会分别增加或减少另一个变量。
问题1:气体
根据__________定律,温度升高就会__________恒压恒摩尔下的体积。
博伊尔的…减少
博伊尔的…增加
查尔斯的……增加
查尔斯的……减少
查尔斯的……增加
回想一下查理定律定义了恒定压强和恒定摩尔时温度和体积之间的关系。这一定律说明这两个变量是成正比的。这意味着温度的升高或降低对体积的影响是相同的。这是有道理的,因为温度升高会增加粒子的动能。这使得粒子更容易彼此远离和膨胀,从而导致体积的增加。
问题1:气体定律
在实验室中正在分析一个未知的气体。你好



氯
氮
氧
氩
氧
为了解决这个问题,我们需要使用理想气体定律方程:
上图中,







重新排列理想的气体法并解决
问题说的是你在容器中放入一克气体。既然我们知道了摩尔数,我们就可以求出气体的分子量并从分子量中求出它的性质。
氧气的分子量,

问题1:气体定律
在0.959Atm的压力下的氩气样品和温度
如问题所述,氩气处于恒定温度下,体积和压力都在变化,因此我们需要使用波义耳定律:
我们被赋予初始压力,初始体积和最终压力,并需要解决最终体积。因此,我们可以重新排列博伊尔的法律如下:
插入已知值并求解。
问题2:气体定律
甲烷气体样品在0.723Atm的压力下和温度的压力下
作为问题状态的甲烷气体在恒定温度下,具有不同的体积和压力,因此我们需要使用博尔的法律:
我们已知了初始压强,初始体积,和最终体积我们需要求出最终压强。因此,我们可以重新排列博伊尔的法律如下:
插入已知值并求解。
问题1:实与理想气体
鉴于理想的气体法:
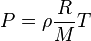
哪里




基于理想的气体法,以下哪项是真的?
一、压力与体积成反比
二,。压力和密度成反比
3压力和温度成正比
密度和温度成反比
v R和M成反比
III, IV, V
I,III,IV
第三,我
I,II,III,IV,V
II,III,V
I,III,IV
条件I为真。压力和体积成反比。我们可以重新推导出理想气体的体积定律来说明:
我们引入摩尔的表达式:
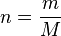
哪里


重新安排(1)解决
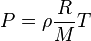
我们得到:

最后,我们使用以下密度,在哪里
质量抵消了,我们得到了用体积和摩尔表示的理想气体定律。
条件II是假的。从方程中清楚地,压力和密度直接比例。
条件III为真,因为从方程中可以清楚地看出温度和压力是成正比的。
条件IV是正确的,因为密度和温度在分子方程式的同一侧,所以温度必须成反比。
条件V是假的,因为理想的气体恒定和摩尔质量可以重新排列到等式的相对侧和分子中。
问题1:气体
在什么条件下气体会偏离理想?
一、低温
二,。高温
3低压
IV。高压力
V.气体总是理想的行为
二、三
v ..
我和四
II和IV.
I和III
我和四
气体在低温和高压下偏离理想条件。这是因为气体分子运动理论的假设忽略了分子的体积和所有气体分子之间的相互作用。然而,这两种情况对真实的气体都不成立。随着温度的升高,粒子的动能可以克服分子间的吸引力或排斥力。在高压和随后的小体积下,分子之间的距离变得更短,因此分子间的作用力变得显著。所以,理想的条件是分子之间的距离很大,每个分子的能量相对于分子间力的大小要大得多。当压力低而温度高时,就会发生这种情况。
问题1:气体
给出范德华方程:
哪个陈述准确识别并解释了van der Waals对理想气体法的修正,其中第一个纠正是

第一校正通过作为分子数量的函数减小的函数来校正分子的体积,并且通过降低压力来校正分子吸引力,因为体积降低和分子的数量增加。
第一校正通过增加体积作为分子数量的函数来校正分子的体积,并且通过增加压力随着体积的增加而增加的分子吸引力来校正第二校正。
第一校正通过增加体积作为分子数量的函数来校正分子的体积,并且通过降低压力来校正分子吸引力,因为体积增加和分子的数量增加。
第一次修正通过减小体积来修正分子的体积,这是分子数量的函数;第二次修正通过增大压强来修正分子的吸引力,这是随着体积的增加和分子数量的增加。
第一次修正通过增加分子数量的函数来修正分子的体积,第二次修正通过随着体积减小和分子数量增加而增加压力来修正分子的吸引力。
第一校正通过作为分子数量的函数减小的函数来校正分子的体积,并且通过降低压力来校正分子吸引力,因为体积降低和分子的数量增加。
所有的表述都说了类似的事情,但只有一个表述正确地确定了体积和压强的变化。让我们通过纠正来分解事情。
更正1:
校正会减小体积,因为它是减法的
纠正2:
因为我们在做减法





































