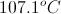例子问题
问题31:溶液化学
正常沸点和冰点的值,以及

一个
醋酸中的氯化钠
醋酸磷化镁
苯氯化钠
苯中的磷化镁
醋酸磷化镁
沸点升高取决于三个变量:溶剂的沸点升高常数、溶质的范霍夫系数和溶液的质量摩尔浓度。在这个问题中,质量摩尔浓度保持不变。
首先,计算每种化合物的范霍夫方程。
最终,我们寻找的是沸点升高常数和范霍夫系数的最大乘积(因为质量摩尔浓度是常数)。
磷化镁具有较大的范霍夫系数,醋酸具有较大的沸点升高常数。因此,醋酸中的磷化镁溶液的沸点升高幅度最大。
问题2:依数性
正常沸点和冰点的值,以及




我们首先需要用方程求出沸点高度:
磷酸铵的范霍夫值是4;每个分子在溶液中分解成四个离子。为了计算质量摩尔浓度,我们需要找出每千克溶液中溶质的摩尔数。
接下来,利用质量摩尔浓度、范霍夫系数和沸点升高常数来求解沸点的升高。
把这个量加到纯水的沸点上,就可以得到溶液的沸点。
问题1:沸点
沸点是液体开始转变为气态所需要达到的温度。露营者和徒步旅行者在旅途中准备食物时,必须考虑到海拔上升时大气压力的差异。在上升过程中,大气压力的下降会改变水沸腾的温度。
使问题更加复杂的是,观察到在纯液体中加入溶质也会改变沸点。拉乌尔定律可以用来理解沸点的变化,如果有不挥发的溶质存在,如这里所示。
在这个法律,


在科罗拉多州一座海拔13000英尺的山上,两名露营者正在准备食物。当他们烧开一壶水时,下列哪项是正确的?
他们烹饪食物的时间可能要比在海平面上的时间短,因为要使蒸汽压与大气压匹配需要更多的热量
他们烹饪食物的时间可能要比在海平面上长,因为使蒸汽压与大气压力匹配所需的热量更少
他们烹饪食物的时间可能要比在海平面上的时间短,因为使蒸汽压与大气压力匹配所需的热量更少
他们烹饪食物的时间可能要比在海平面上长,因为要使蒸汽压与大气压匹配需要更多的热量
如果他们在水中加入盐,这将有助于加快水沸腾的速度
他们烹饪食物的时间可能要比在海平面上长,因为使蒸汽压与大气压力匹配所需的热量更少
13,000英尺处的当地大气压力低于海平面的压力;因此,使蒸汽压满足局部大气压需要的热量更少。当水转化为蒸汽时,添加到系统中的热量很容易再次排出,从而减少了水中用于烹饪食物的热量。因此,食物煮起来更慢。
问题4:依数性
沸点是液体开始转变为气态所需要达到的温度。露营者和徒步旅行者在旅途中准备食物时,必须考虑到海拔上升时大气压力的差异。在上升过程中,大气压力的下降会改变水沸腾的温度。
使问题更加复杂的是,观察到在纯液体中加入溶质也会改变沸点。拉乌尔定律可以用来理解沸点的变化,如果有不挥发的溶质存在,如这里所示。
在这个法律,


加入溶质后沸点的变化是溶液的依数性质。下列哪项也是依数性的例子?
一、蒸汽压降低
2有溶质溶解的颜色发射
3渗透压
I, II,和III
只有我和我
只有II和III
第三,只有
只有I和III
只有I和III
依数性质被定义为完全取决于溶质粒子数与溶剂粒子数之比的性质。只有渗透压和蒸气压下降是这种现象的例子。虽然颜色发射是溶液的一种属性,但它取决于所涉及的化学物质,而不是粒子的数量。
问题5:依数性
假设两个容器各装有等量的溶剂。在第一个容器中加入2m NaCl溶液,在第二个容器中加入神秘溶液。加热烧瓶后,可以确定第二个容器的沸点比第一个容器的沸点高。假设解决方案是理想的。
根据以上信息,下列哪一种化合物可以加入容器2?
1 m氯化钠
3 m C6H12O6
2 m CaF2
1米MgCl2
2 m CaF2
根据方程

加入容器1中的氯化钠的质量摩尔浓度是2,范霍夫系数也是2。因此,我们正在寻找一种化合物,它具有更大的这两个因素的结合,这将导致更高的沸点。2 m CaF2质量摩尔浓度是2范霍夫系数是3。由于容器2中的因子组合要高于容器1中的因子组合,我们可以得出结论,这就是添加到更高沸点容器中的神秘化合物。
请注意,C6H12O6是葡萄糖的分子式,在溶液中不会电离。
问题6:依数性
沸点升高方程为
“
如果溶液中发生了离子配对,哪个说法是正确的?
溶液的质量摩尔浓度会降低。
溶质不会提高溶液的沸点。
溶液的蒸汽压将低于预期。
实际沸点升高会低于理论沸点升高。
实际沸点升高会低于理论沸点升高。
如果溶液中发生离子配对,范霍夫系数将比预测略低。结果,沸点不会像所有离子彼此分离时那样升高。这个结论可以从给定的方程中得出,
问题1:依数性
下列哪一种溶液的沸点最高?
2 m氯化钠
2 m MgCl2
1米氟化钠
1米MgCl2
2 m MgCl2
为了回答这个问题,考虑沸点升高的方程:


问题8:依数性
哪种溶液的沸点更高?
解决方案1:

解决方案2:

解决方案1
溶液1和2的沸点相同
从给出的信息不能确定答案
解决方案2
解决方案1
向水中加入溶质会导致沸点升高,因为有更多的分子存在。温度的变化由关系式给出



自




问题1:依数性
下列哪一种化合物添加到水溶液中会产生最大的沸点增加?
依数性质只取决于溶液中粒子的数量,而不是它们的同一性。依数性的一些例子有蒸气压、沸点、冰点和渗透压。
沸点升高与溶液中存在的粒子数有直接关系。溶液中粒子越多,沸点升高越高。
我们正在寻找一种化合物,当它溶解在溶液中时,能够产生最多的离子。
氯化钠和硫酸镁每摩尔会产生两个离子。
氯化镁和氯化钡每摩尔会产生3个离子。
每摩尔氢氧化钙也会产生3个离子,但是我们给出的是2摩尔而不是1摩尔。
氢氧化钙会产生最多的离子,从而使沸点升高幅度最大。
第41题:溶液化学
将下列每种溶液加入等量的水中。哪种解决方案将导致最大程度的沸点升高?
沸点升高是一种依数性,这意味着它取决于溶液中溶质粒子的相对数量。摩尔数最大的选项粒子将显示最大沸点升高。沸点升高方程为:
质量摩尔浓度等于每千克溶剂中溶质的摩尔数,也就是说它与加入的溶质的摩尔数成正比。每种溶质加入等量的水,使这个值保持不变。同样的,
根据这个比例,我们可以找到对水的沸点影响最大的溶质。
由于氯化钠导致溶液中离子的量最大,它将产生最大的沸点升高。