例子问题
问题1:图和几何
哪个选项正确地描述了氯化钠的刘易斯点结构?






当绘制路易斯点结构时,我们总是试图达到所有原子都是稳定的并且(通常)有完整的八位体的电子数。我们还试图建立一个结构,在这个结构中,我们有尽可能小的形式电荷。一般的规则是首先画出所有参与的元素和它们的价电子,然后把它们拼在一起试图减少形式电荷让所有参与的元素变成八隅体。八隅体规则也有一些例外。
钠和氯形成离子键,这意味着一个原子提供一个电子,另一个原子接收它。这给每个原子一个电荷。氯有7个价电子,钠有1个价电子。每个原子要达到八隅体,钠需要失去一个电子,氯需要得到一个电子。这样氯就带负电荷,钠带正电荷。
因此,答案是带正电荷的钠(由于失去了一个电子)和带8个电子和负电荷的氯(由于获得了一个电子)。
第47题:化合物和成键
路易斯点结构是什么






当绘制路易斯点结构时,我们总是试图达到所有原子都是稳定的并且(通常)有完整的八位体的电子数。我们还试图建立一个结构,在这个结构中,我们有尽可能小的形式电荷。一般的规则是首先画出所有参与的元素和它们的价电子,然后把它们拼在一起试图减少形式电荷让所有参与的元素变成八隅体。八隅体规则也有一些例外。
在这种情况下,硼实际上有一个不完全八隅体。虽然有一些共振形式,硼有一个完整的八隅体,当你计算这些构型的形式电荷时它不会是零。
问题1:Vsepr理论
下面哪个分子的键角最大?
根据VSEPR理论,在一个分子中,原子会调整自己的方向,以便尽可能远离邻近的原子。这个理论有助于预测分子的几何形状,以及原子之间的键角。

所有已知的分子的键角都小于180度。
问题4:Vsepr几何
下面哪个选项不是给定分子的正确几何构型?
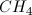





回想一下中心原子上的几何形状和电子对数目之间的关系。
2:线性
3:三角形的平面
4:四面体
5:三角形bipyriamidal
6:八面体
为了使几何图形形象化,我们需要考虑中心原子上有多少对电子。在这里画Lewis点图可能会有帮助。除了水以外,所有的答案都没有单独的中心电子对,所以束缚在中心原子上的原子数和中心电子对的数量是相同的。
唯一不符合正确几何的是SF6,它实际上是八面体,因为它有6对中心电子。在水分子中,中心的氧有6个价电子,再加上与氢的每个键的一个电子,总共有8个中心电子和4对中心电子。因此,这种几何结构是四面体形式(弯曲)的一种变化,其中两个中心电子对不受束缚。
问题1:分子与电子几何
下列哪个分子表现出三角锥体的几何结构?
三角锥体几何是由中心原子有三个原子和一个孤对连接的分子实现的。



问题2:分子与电子几何
下列哪个分子的电子几何结构与其分子几何结构相同?
只有当分子中心原子周围没有孤对时,电子和分子的几何形状才相同。
问题1:分子与电子几何
它的分子形状是什么
四面体
八面体
三方晶系的双锥体
三角形的平面
三角金字塔形
三角金字塔形
NH3.是三角锥体的,因为它有4个电子区域,其中一个是孤对电子,另外3个是H原子。当它被安排在一个三维空间时,它在形状上是三角金字塔。














