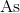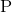例子问题
例子问题81:介绍主题
下列哪一种元素最具金属性质:
元素的金属特性随着你往下移动而增加。所有列出的元素都在第5组中。自
例子问题2:周期性规律
下面哪个元素的原子半径最大:
在看元素周期表时,你应该注意到所有这些元素的周期都是相同的。回想一下,原子半径随着周期向右移动而减小。因此,这是元素通过减小半径的顺序:

示例问题3:周期性规律
一组第一电离能最高的元素被称为下列哪一项?
碱土金属
碱金属
卤素
准金属
惰性气体
惰性气体
稀有气体有整整八电子。它们有最大的第一电离能因为它们倾向于保留所有的价电子。卤素的电子亲和度最高;因此,它们的电离能很高,但不是最高的。碱金属和碱土金属具有较低的电子亲和力和较低的电离能。最后,金属具有不高不低的电离能。
示例问题4:周期性规律
按金属性质增加的顺序排列以下:
正确答案是




示例问题5:周期性规律
这些原子中哪个最小?
镁
锶
钡
铍
钙
铍
原子半径是指一个原子不与任何其他原子成键时的大小。元素周期表可以用来估计原子的原子半径的大小。当你在元素周期表上往下移动,原子半径就会增加,但当你在元素周期表上从左到右移动,原子半径的大小就会减小。
铍、镁、钙、锶和钡在元素周期表上都属于同一组,所以最小的元素是离周期表顶部最近的元素,因为原子在周期表上越往下,原子越大。因此,这个基团中最小的原子是铍。
示例问题6:周期性规律
哪个原子的电负性最大?
磷
硫
氯
铝
硅
氯
电负性是指原子吸引和结合电子的能力。如果价电子不足半满,那么失去一个电子所消耗的能量就比得到一个电子所消耗的能量要少,使得这些原子的电负性更低。如果价电子多于一半满,那么得到电子所消耗的能量就比失去电子所消耗的能量要少;因此这些电子的电负性更强。元素周期表可以用来预测原子的电负性以及它与其他原子的比较。当你从左到右移动元素周期表,电负性增加,因为在元素周期表右边的原子有更多的价电子,更小的半径。随着元素周期表向下移动,电负性减小,因为原子序数增加,导致价电子和原子核之间的距离变大,对价电子的引力减小。
利用电负性周期趋势,我们可以预测哪个原子的电负性最大。铝、硅、磷、硫和氯都在元素周期表的同一行。因此,氯的电负性是最强的因为它在元素周期表上是最右边的所以它有最多的价电子它得到一个电子的能量比失去一个电子的能量要少。
示例问题7:周期性规律
下面哪个原子最大?
铝
磷
硫
钠
氯
钠
原子半径是指一个原子不与任何其他原子成键时的大小。元素周期表可以用来估计原子的原子半径的大小。当你在元素周期表上往下移动,原子半径就会增加,但当你在元素周期表上从左到右移动,原子半径的大小就会减小。
钠、铝、磷、硫和氯都在元素周期表的同一行。由于原子半径的大小随着元素周期表从左到右的移动而减小,最左边的元素将是最大的。因此,钠是基团中最大的原子。
示例问题8:周期性规律
哪个元素的电负性最小?
硫
硒
钋
碲
氧气
钋
电负性是指原子吸引和结合电子的能力。如果价电子不足半满,那么失去一个电子所消耗的能量就比得到一个电子所消耗的能量要少,使得这些原子的电负性更低。如果价电子多于一半满,那么得到电子所消耗的能量就比失去电子所消耗的能量要少;因此这些电子的电负性更强。元素周期表可以用来预测原子的电负性以及它与其他原子的比较。当你从左到右移动元素周期表,电负性增加,因为在元素周期表右边的原子有更多的价电子。随着元素周期表向下移动,电负性减小,因为原子序数增加,导致价电子和原子核之间的距离变大,对价电子的引力减小。
利用电负性周期趋势,我们可以预测哪个原子的电负性最小。氧、硫、硒、碲和钋都在元素周期表的同一组中。因此,钋的电负性最小,因为它最接近元素周期表的底部,原子序数最大。因为钋的原子序数最大,所以价电子与原子核之间的距离更大,导致对价电子的引力减小。因此,与原子序数较小的原子相比,它更容易失去价电子。