例子问题
问题81:酸碱反应
在接下来的反应中,哪个是共轭酸?
HCO3 -+ HCl→H2CO3.+ Cl -
HCO3 -
Cl -
盐酸
H2CO3.
H2CO3.
共轭酸比与之比较的化合物多一个H+。因此,H2CO3.是HCO的共轭酸3 -.
问题81:酸碱反应
关于中和反应,下列哪项是不正确的?
这是一个特殊的双置换反应。
酸碱之间有反应。
它有两个反应物和两个生成物。
盐和水之间有反应。
盐和水之间有反应。
中和反应的生成物是盐和水,而不是反应物。其余的选项都正确地与中和反应有关。
问题111:反应类型
碱中应该含有下列哪一种化学基团?
氢氧化
氯
氢
羧基
碳酸氢
氢氧化
碱可以定义为从溶液中猝灭氢离子的物质。氢氧根离子和氢离子在溶液中结合形成水。回想一下碱溶液的pH值在7到14之间。
问题112:反应类型
下列哪个基团可能存在于酸中?
氢
氯
羧基
碳酸氢
氢氧化
氢
酸可以定义为向溶液中提供氢离子的物质。如果一个分子上有一个氢基团,它就有可能被捐赠到溶液中,这将导致pH值下降。
问题177:反应与平衡
哪种化合物可以既是质子酸又是质子碱?
根据Bronsted-Lowry的定义,酸是一种能提供一个氢离子并形成共轭碱的物质;一个质子碱接受一个氢离子并形成共轭酸。因此,我们正在寻找一种既能提供氢离子也能接受氢离子的物质(两性)。亚硫酸氢盐可能会放弃一个质子

问题81:酸碱反应
下面哪个是路易斯酸,而不是布朗斯特-洛瑞酸?
为了回答这个问题,我们需要理解酸的不同定义。酸有三个重要的定义。
1.阿伦尼乌斯酸
这些化合物,加入水中,会增加浓度
2.质子酸
这些是任何可以释放的酸
3.路易斯酸
这是酸最一般的定义。它是任何可以接受孤电子对的化合物。
路易斯酸是最常见的一种酸,这意味着任何一种是布朗斯特-洛瑞酸或阿伦尼乌斯酸也都是路易斯酸。然而,反过来就不对了。并非所有的路易斯酸都属于Bronsted-Lowry或Arrhenius的范畴。
这个问题的正确答案是氯化铝。我们可以看到,根据铝在元素周期表中的位置,它的外层有三个价电子。这些电子中的每一个都和氯原子形成一个共用键。这意味着氯化铝中的铝有6个价电子。然而,由于铝的最大容量为8个价电子,所以它还有空间容纳另外两个价电子。这个空位允许氯化铝的铝组分接受来自任何电子供体的电子对。因此,氯化铝是一种路易斯酸。然而,氯化铝没有办法生产
示例问题21:强酸和强碱中的磷、氢和磷
下列哪个是强酸?
醋酸
乳酸
甲酸
硝酸
Hydroflouric酸
硝酸
这个问题只是测试你对强酸和弱酸的记忆。在这个列表中,你应该认识到硝酸是唯一的强酸,其他的都是弱酸。
例子问题1:利用酸解离常数(Ka)
下列哪一项决定酸的强度?
卡的
物理状态
电负性值
知识库
中心原子有多少键
卡的
Ka是酸的解离常数,因此它决定了酸的强度。较强的酸解离程度较大,产生较低的pH值。
示例问题31:酸和碱
1M的单质子酸溶液的pH值为4.6。什么是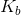
为了求出共轭碱的碱解离常数,我们可以从求酸的酸解离常数开始。由于1M的酸溶液的pH值为4.6,我们可以求出溶液的质子浓度。
由于酸是单质子的,我们可以将下面的平衡表达式设为它的酸解离常数。
我们可以看到,由于酸是单质子的,质子的浓度就等于酸的阴离子的浓度。酸分子的最终浓度等于初始浓度,减去形成的质子数。利用这些值,我们可以解出酸的平衡常数。
现在我们有了酸的解离常数,我们可以通过使这两个值的乘积等于水的自电离来求出共轭碱的解离常数。
示例问题21:强酸和强碱中的磷、氢和磷
将H2所以4或HNO3.产生酸性更强的溶液?
HNO3.因为它有更高的pKa
H2所以4因为它有更高的pKa
HNO3.因为它的pKa值较低
H2所以4因为它的pKa值较低
H2所以4因为它的pKa值较低
两者都是强酸,但是H2所以4是二价的,每个溶解在溶液中的分子释放2个质子。此外,酸性越强的溶液pKa值越低。













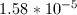

![pH=-\log[H^+]\rightarrow [H^+]=10^{-pH}](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/121717/gif.latex)
![\small [H^{+}] = 10^{-4.6} = 2.51*10^{-5}](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/94835/gif.latex)
![\small K_{a} = \frac{[H^{+}][A^{-}]}{[HA]}](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/121718/gif.latex)
![K_a= \frac{[2.51*10^{-5}]^{2}}{[1-2.51*10^{-5}]} = 6.31*10^{-10}](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/94836/gif.latex)