例子问题
例子问题51:动力学和能量
下图显示了能量是如何随着化学反应而变化的


化学工程师既想增加产量,又想加快反应速度。他应该__________.
提取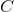
只使用催化剂
只提高温度
提取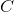
提取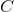
“升高温度”是不正确的,因为我们有一个放热反应,通过升高温度平衡常数会变小。温度的升高会使平衡向反应物倾斜。根据勒夏特列原理,通过提取

例子问题1:反应能量配置文件
如果正向反应的活化能大于反向反应的活化能,则该反应为__________.
吸热
uncatalyzed
自发的
放热
吸热
如果正反应的活化能大于逆反应的活化能,那么生成物的焓一定比反应物的焓高(画一个势能图来可视化)。
例子问题2:反应能量配置文件
如果正向反应的活化能大于反向反应的活化能,那么这个反应的活化能是什么?
这是放热
它处于平衡状态
这是非自发
这是吸热的
它是自发的
这是吸热的
如果正反应的活化能大于逆反应的活化能,则生成物的焓一定比反应物高。因此,净焓变是正的,这意味着它是吸热的。
例子问题1:反应能量配置文件
关于活化能,下列哪项是正确的?
1、活化能取决于系统的压力
2反应速率随活化能的增加而减小
3催化剂增加反应的活化能
我只
我和第三
我和二世
二只
二只
活化能是反应进行所需要克服的能垒;活化能越高,反应越慢。活化能只能通过催化剂来改变。催化剂是一种化学物质,它能降低活化能,使反应进行得更快。其他物理量,如温度和压力,不会改变活化能。
反应速率是反应速度的直接度量。如前所述,活化能的增加会增加势垒,从而使反应变慢。
催化剂是降低活化能,从而提高反应速率的化学物质。它们通常用于化学反应中,以大大加快可能需要数小时或数天才能完成的反应。酶是生物催化剂,促进了我们体内发生的大多数生物反应。
例子问题1:反应能量配置文件
__________反应的活化能__________生产的产品数量。
在减少……增加
越来越多……不会改变
在减少……减少
越来越多……增加
越来越多……不会改变
这个问题是关于反应的活化能(动力学)和生成物的数量(平衡)之间的关系。记住,改变反应的速度(动力学)并不会改变反应的平衡。增加或减少活化能(它会改变反应的速度)只会分别允许反应进行得更慢或更快。它不会改变最终生产的产品数量。
例子问题1:反应能量配置文件
下列哪一项是计算反应活化能的正确方法?
跃迁态能-反应物能=活化能
生成物能-跃迁态能=活化能
反应物能-跃迁态能=活化能
跃迁态能-生成物能=活化能
跃迁态能-反应物能=活化能
活化能是跃迁态能量和反应物能量的差值。回想一下,活化能是反应需要克服的能垒。过渡态是位于反应物和生成物之间的高能中间分子。它是在反应物变成生成物的过程中产生的。因此,要得到生成物,就必须经过这种高能跃迁态。
活化能是爬上这个能量“山”所需的能量(从反应物到跃迁态所需的能量);因此,活化能是跃迁态的能量(能量丘/势垒顶部)减去反应物的能量。
例子问题1:反应能量配置文件
考虑一下下面的反应:
的转换



逆反应的活化能是多少?
不能从给定的信息中确定
要回答这个问题,我们必须考虑放热反应的能量图。我们知道正向反应是放热的,因为问题说能量被释放了。已知反应的活化能(活化的络合物或过渡态与反应物之间的能量差)和释放的能量(生成物与反应物之间的能量差)。在逆向反应中,我们将从生成物到反应物的过程如下:
这意味着反向反应的活化能会更高(从“生成物”到“活化的配合物”需要爬更高的山)。根据所给的信息,我们可以推导出活化能(
最接近的答案是


例子问题2:反应能量配置文件
关于活化能,下列哪项是正确的?
催化剂能增加反应物的能量
反应的焓对活化能没有影响
活化能决定反应的平衡常数
升高温度会降低活化能
反应的焓对活化能没有影响
回想一下,唯一能改变反应活化能的是催化剂的加入。诸如焓、熵、温度和压强等因素不会改变活化能。
催化剂降低了活化能,提高了反应速率。它们对反应物的能量没有影响。如前所述,温度不会改变活化能;然而,提高温度会加快反应的速度。这是因为以热的形式增加能量会增加反应中单个分子的能量,从而使更多的分子克服能垒。然而,请注意,温度不会改变能量位垒(活化能)。记住,改变活化能对反应的平衡没有影响;因此,平衡常数不取决于活化能。











