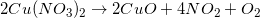例子问题
例子问题2:帮助分离反应
上述反应可归为__________.
单一的位移
合成
氧化还原
分解和氧化还原
分解
分解
当一个分子转化为两个或更多的小分子时,这个反应被认为是分解反应。在这个例子中,没有一个元素的氧化值发生变化,所以这不是一个氧化还原反应。(钙总是


例子问题1:介绍了反应
下列哪项表示燃烧反应?
燃烧反应总是产生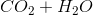
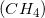

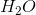
例子问题2:化学平衡方程
化学家将溶解的钾离子和砷离子混合在溶液中形成的盐的化学式是什么?
钾是I族元素,所以要到达充满的价层,它会失去一个电子
砷是第5族元素,所以它需要得到3个电子才能得到一个充满的价层
为了平衡电荷,合成的盐将会
例子问题1:化学方程式
硫酸亚铁和碘化钙离子交换反应的净离子方程是什么?假设所有化合物都是可溶的。
没有可用的答案
首先,我们必须知道什么是硫酸亚铁。黑色是指


钙是一价阳离子,碘是一价阴离子,所以它们的盐是
示例问题7:化学平衡方程
从这个分子反应中选择净离子方程:
其他选项都没有
净离子方程是通过从总离子方程(其中所有离子都被列出)中去除所有旁观者离子得到的。换句话说,净离子方程只涉及参与反应的离子,在这种情况下,就是硫酸钡的沉淀。
首先把所有的水化合物都写成解离(离子)形式。
消去方程两边等量出现的离子。在这种情况下,我们可以消去硝酸盐和钾离子。
这是净离子方程。
例子问题1:确定反应类型
丁烷燃烧的配平化学方程式是什么
燃烧是碳氢化合物与分子氧的化学反应,它总是产生二氧化碳和水。知道了反应物和生成物,不平衡方程必须是:
我们从平衡氢原子开始。因为左边有10个,右边只有2个,所以我们把水的系数设为5。
同样地,我们通过给二氧化碳加4来平衡碳。
为了求出右边的氧的数量,我们将系数4乘以O上的下标2(得到8个氧),然后将5个水分子中的5个氧相加,总共得到13个。所需系数为
因为分数系数是不允许的,我们将每个系数乘以2来求最终反应:
例子问题1:化学方程式
测定固体铝是否与氯化锌水溶液发生反应。如果是,确定反应的配平方程。
不发生反应
当我们检查活性系列时,很容易看出金属铝比金属锌反应性更强。在这种情况下,两种金属发生氧化还原反应,水溶液



因为

我们注意到左边有2个氯原子右边有3个氯原子。为了平衡,我们在左边用3的系数,在右边用2的系数。这样一来,每个原子上总共有6个氯原子。
但是,现在我们也增加了锌和铝的含量。我们复制必要的系数来平衡它们——左边是铝的2,右边是锌的3——我们就完成了:
例子问题1:介绍了反应
这个方程的净离子形式是什么?
要找到这个化学方程的净离子形式,首先要平衡这个方程,然后解离所有可溶组分。换句话说,把水分子分成两个独立的分子/原子。例如,



如果适用的话,写出每个物种的解离形式。
划掉出现在等式两边的物种。净离子方程为:
示例问题14:化学反应
系数是什么
解决这个问题的最好办法是尝试所有可能的答案。当我们试8时,






示例问题15:化学反应
考虑到锂在活性级数上比氢高,当固体锂和盐酸混合时应该看到什么?
这些
增加试管温度
泡沫
没有变化
颜色的变化
泡沫
考虑到锂比氢更具活性,预计会发生一次取代反应,因此锂将取代氢。
所有的离子化合物在室温下都是固体,这就是为什么氯化锂有固相标记。记住,氢是一种双原子元素,在室温下是气体。当观察从溶液中产生气体的反应时,可以看到气泡。没有任何迹象表明这个反应是吸热的还是放热的,也没有任何信息表明这个反应应该改变颜色。