例子问题
例子问题1:分子间力与稳定性
将下列化合物按沸点递增排列,从最低沸点开始排列。
即1-pentanol
2戊烷
32, 2-dimethylpropane
第四。R) 4-hydroxypentanoic酸。
Ii < iii < I < iv
Iv < I < ii < iii
Iii < ii < I < iv
Iii < ii < iv < I
Ii < iii < iv < I
Iii < ii < I < iv
沸点高度依赖于化合物的分子间作用力。分子间作用力强、质量大、分支少的化合物沸点高。
化合物II和III只表现出分子间伦敦色散力,所以它们是两个沸点最低的化合物(分子间力最弱)。因为化合物III有更多的分支,这些伦敦色散力会更弱,导致沸点比化合物II低。
Iii < ii
化合物I和IV将是沸点较高的化合物,因为有额外的氢键(强分子间作用力)。化合物IV的沸点最高,因为羟基和羧基都能参与分子间氢键。此外,化合物IV更极性(更极化的碳-氧键),导致更大的偶极-偶极引力。
Iii < ii < I < iv
例子问题1:分子间作用力的帮助
关于炔,下列哪一种说法是正确的?
末端炔是比内部炔更强的化合物
内炔比末端炔更稳定
炔的三键由三个π键组成
末端炔的酸性比内部炔弱
炔很容易溶于水
内炔比末端炔更稳定
答案是“内炔比末端炔更稳定”,因为这是关于炔的唯一正确陈述。内炔更稳定,因为它们比末端炔有更好的共轭体系。共轭体系是由单键,多键,单键等等组成的体系。共轭体系总是比非共轭体系更稳定。从下图可以看出,内炔遵循共轭体系,末端炔不遵循共轭体系。

例子问题3:分子间力与稳定性
下列哪种化合物最易挥发(沸点最低)?
![]()
V
2
4
3
我
3
在比较化合物的相对挥发性时,必须考虑化合物的分子量,以及在有关化合物的样品中发现的相同分子之间的分子间吸引力。
我们可以排除选项I、II和v。这些化合物具有具有极化X-H键的官能团,允许这些化合物样本中的分子参与氢键。氢键具有很强的吸引力,因此需要注入更多的能量使样品蒸发(煮沸液体样品)。换句话说,氢键会提高沸点降低这些化合物的挥发性。
答案IV以烷基溴为特征,也可能被淘汰,原因有二。首先,由于溴比碳重得多,分子IV将比分子III重得多,因此需要更多的能量才能转变为气态。其次,由于溴具有相当的电负性,因此分子碳溴键中存在偶极子,因此IV样品会发生偶极子-偶极子吸引相互作用。如上所述,吸引的分子间相互作用需要更多的能量来克服,以使样品经历液相-气相变化。因此,分子IV的挥发性小于分子III,这是正确答案。
问题4:分子间力与稳定性
下面哪一个的蒸汽压最高?
戊烷
辛烷
乙醇
醋酸
戊烷
具有最高蒸汽压的化合物具有最弱的分子间作用力。辛烷和戊烷只有伦敦色散力;乙醇和乙酸有氢键。氢键比伦敦色散力强得多。因为辛烷比戊烷大,所以它的伦敦色散力更大,因此戊烷的分子间作用力最弱。
例5:分子间力与稳定性
下面哪个分子的沸点最高?

例子问题6:分子间力与稳定性
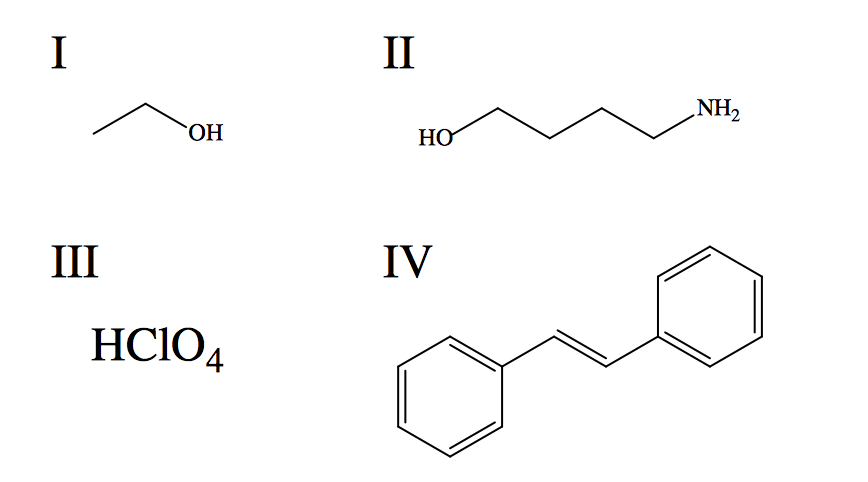
按增加的水溶解度给给定的物种排序。
二,四,三,一
四,一,二,三
二,四,一,三
I, ii, iii, iv
四,二,一,三
四,二,一,三
“物以类聚”是处理溶解度趋势时要牢记的一个很好的指导原则。也就是说,极性溶剂比非极性溶剂更容易溶解极性溶质;反之亦然。水是极性溶质,形成强氢键(分子内和分子间),这是能量上有利的相互作用。具有氢键能力的溶质很容易溶解在水中,因为它们不会显著破坏分子内氢键的网络。为了预测给定化合物的溶解度,定义每种化合物在引入水时所经历的主要分子间作用力是有用的。I:氢键在甲醇和水的相互作用中占主导地位(两者是混溶的)。II:存在氢键,但溶解度因多碳链的存在而降低,这增加了结构的显著非极性特征。III:高氯酸是一种强酸(比硝酸和硫酸强),这意味着它在水中完全解离,形成非常与水的强离子偶极相互作用。对给定相互作用的评估导致溶解度增加的正确趋势:IV, II, I, III。
示例问题7:分子间力与稳定性
下面哪个分子的蒸汽压最低?
蒸汽压最低的分子是分子间作用力最强的分子。除了戊烷,所有这些分子都有氢键的能力。然而,
例8:分子间力与稳定性
在下列分子间作用力中,哪一种力通常能使纯化合物的沸点最高?
网络共价力
取向interractions
氢键
离子键
网络共价力
乍一看,我们会急于把离子键作为正确答案,因为离子键提供了非常高的沸点。然而,正确的答案是一种罕见的分子间力,称为网络共价键。网络共价键通常见于金刚石和石英中,它是一种比离子键更强的分子间作用力。氢键是第二强的分子间作用力,也能提高纯物质的沸点。
问题9:分子间力与稳定性
下列哪一个的沸点最低?
戊烷
异戊烷
丁烷
异丁烷
异丁烷
一般来说,分子间相互作用的增加和分子间力的增大导致分子沸点的增加。相反,分子间相互作用的减少和分子间作用力的减小导致分子沸点的降低。
在这种情况下,这些分子所表现出的唯一的分子间力是伦敦色散力。伦敦色散力的大小随着分子尺寸(碳链长度和分子表面积)的减小而减小。因此,在这个问题中,最短、分枝最多的分子沸点最低。正确答案是异丁烷,一种四元分支烃。
例子问题10:分子间力与稳定性
下面哪个分子的沸点最低?
2,3-二甲基丁烷
2-methylpentane
戊烷
己烷
2,3-二甲基丁烷
当讨论碳氢化合物的沸点时,重要的是要记住分支降低了分子的沸点。我们可以先排除己烷和戊烷,因为它们都没有分支。从这里,我们可以得到2,3-二甲基丁烷作为答案,因为它比2-甲基戊烷更分枝。根据沸点对碳氢化合物进行排序时,碳的数量也很重要——碳越多,沸点就越高。













