例子问题
问题1:热化学和热力学
恒温时,吉布斯自由能定义为:
在那里,



以下哪一种情况是不可能的?
以下情况是不可能的:
这是因为如果焓是正的,熵是负的,公式中温度项前面的负号变成正的。两个正数相加不能为负。将任意数字代入其他条件可以表明它们都是可能的。
以以下条件为例:
然后是吉布斯自由能

问题1:热化学和热力学
恒温时,吉布斯自由能定义为:
在那里,


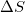
假设一个系统是自发的,下面哪一种状态是可能的?
我。
2
3
4
四只
I, II, III,和IV
I和III
II和III
I, II,和III
I和III
条件1总是为真。条件II永远不会成立,因为如果焓为正而熵为负,吉布斯自由能就不可能为负。如果温度非常高,条件III可能为真(这是当



问题1:热化学和热力学
反应的焓是


不能从给定的信息中确定
不能从给定的信息中确定
系统的吉布斯自由能可以用下面的方程求解。
在哪里




问题1:热化学和热力学
在逸出反应中,生成物有__________吉布斯自由能反应是__________。
更高……自发的
更高……非自发
更低……非自发
更低……自发的
更低……自发的
放能反应表明吉布斯自由能为负。由于吉布斯自由能的变化被定义为生成物的吉布斯自由能-反应物的吉布斯自由能,所以吉布斯自由能的负变化表明生成物的吉布斯自由能低于反应物。如果反应的吉布斯自由能是负的,反应就是自发的;因此,出能反应总是自发的。这是因为反应从不稳定的反应物(高能量)中产生更稳定的产物(低能量)。
问题1:焓和熵
关于焓和熵,下列哪个是正确的?
这两个都是对的
这些都不是真的
液态水的熵比氢气的熵大
液态水的焓是非零的,而氢气的焓是零
液态水的焓是非零的,而氢气的焓是零
焓是化合物中包含的内能的量,而熵是化合物内部无序的量。单质化合物如氢气和氧气的焓为零;因此,水的焓是非零的(与相无关)。熵,或者说无序量,总是气体最高,固体最低。这是因为气体分子分布广泛,因此比固体和液体更无序。氢气的熵比液态水的熵大。
问题2:焓和熵
根据热力学定律,下列哪个陈述是正确的?
系统的焓总是在增加
2系统的熵总是在增加
3绝对熵永远不会是负的
二只
II和III
第三只
I和II
第三只
热力学第一定律指出,宇宙的能量总是恒定的,这意味着能量不能被创造或毁灭。系统损失的能量由环境获得,反之亦然;然而,宇宙的总能量总是恒定的。热力学第二定律指出,熵,或宇宙中无序的数量,总是在增加。这表明宇宙总是朝着更无序的状态发展。根据这两条定律,我们可以确定表述一和表述二是假的。请注意,这两个陈述谈论的是系统,而不是整个宇宙。在一个系统中,能量(以焓的形式)和熵可以增加或减少。环境会相应地补偿,以保持宇宙的能量不变,并增加熵。一个系统、环境或宇宙的绝对熵永远不可能是负的,因为不可能有负的无序(这是由于熵的定义; just remember that entropy can never be negative). Note that the change in entropy can, however, be negative.
问题1:热力学定律
一种新发现的元素的标准熵为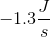
热力学第零定律
等效交换第一定律
热力学第一定律
热力学第三定律
热力学第二定律
热力学第三定律
热力学第三定律指出,在绝对零度下的纯晶体物质的熵为
在哪里
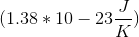
如果系统只存在一个微态,那么熵为零
备注:记住熵变化可以是负的,但是纯化合物的熵不可能是负的。
问题1:热化学和热力学
一种化学反应在其中进行

热力学第一定律指出,对于一个只通过热或功来交换能量的系统:
工作完成了通过因此,这个系统
问题1:热化学和热力学
一种汽车发动机提供

热力学第一定律指出,对于一个只通过热或功来交换能量的系统:
热量是由系统放出的,所以
问题1:热力学
一种化学反应在其中进行

热力学第一定律指出,对于一个只通过热或功来交换能量的系统:
热量吸收因此,是由系统决定的
所以

















































