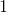例子问题
例子问题1:量子数
下列哪组量子数(

因为我们在看








例子问题1:量子数
下面哪组量子数可能对应于a
因为我们在看






量子数的唯一可能组合是否对应于a
例子问题1:量子数
关于钾和钾离子的量子数可以得出什么结论?
所有钾离子的价电子的轨道角动量量子数与钾离子的价电子的轨道角动量量子数不同
钾的价电子比钾离子的价电子有更高的主量子数
不止一个
钾离子的价电子具有较高的能量
钾的价电子比钾离子的价电子有更高的主量子数
钾有一个价电子。这意味着在它的最外层(第4能层)有一个电子。另一方面,钾离子失去了一个电子,在第三电子层上有一个完整的八隅体(有八个价电子)。回想一下,主量子数表示壳层。因为钾的价电子在第四能层,

轨道角动量数(

电子层数越高的电子能量越高。钾的价电子在第四能层;因此,它的能量比钾离子的任何价电子都要高。
例子问题2:量子数
考虑以下对量子数的描述:
A:亚壳层内的能级
B:轨道形状
C:电子的自旋
D:能量水平
以下哪一项是量子数(1、2、3、4)与所给描述的正确配对?
A:第三,B:第二,C:第四,D:第一
A:第三,B:第四,C:第二,D:第一
A:第四,B:第二,C:第三,D:第一
A:第二,B:第三,C:第四,D:第一
A:第三,B:第二,C:第四,D:第一
有四个量子数。第一个量子,或主量子数,由字母“n”指定。它表示电子的壳层,或电子的能级。第二个量子数,或轨道角动量量子数,由字母“l”指定。它表示轨道的形状(或类型)。第三个量子数,或磁量子数,由





这四个数字一起描述了电子在原子内的潜在位置。注意,任何两个电子都不可能具有相同的量子数集(这意味着四个数字中至少有一个是不同的)。
例子问题1:量子数
关于乙烯,下列哪项是正确的?(答案选项中的电子指的是碳电子)
电子在
中的电子
电子在
电子在

电子在
乙烯或








轨道角动量数是第二个量子数,它表示轨道的类型。a中发现的电子。p'轨道总是有一个

主量子数是第一量子数,它表示电子的壳层或能级。所有参与成键的电子都在碳的最外层(第二层);因此,他们都会有一个


例子问题1:量子数
关于主量子数,下列哪项是正确的?
一、主量子数表示能级
2主量子数永远不可能等于零
3主量子数可以是正的,也可以是负的
我和第三
一,二,三
二只
我和二世
我和二世
量子数是一种奇特的坐标系统,用来描述电子在原子中的潜在位置。第一个量子数称为主量子数,它表示电子所在的壳层。回想一下,电子壳层是原子中具有离散能量的离散轨道;因此,主量子数表示电子的能级。
主量子数总是一个整数,并且总是大于零。如果

例子问题1:量子数
当n = 4时,一个原子有多少亚壳层?
子壳的类型从小到大依次为:s、p、d,而且f.这四个子壳层分别对应以下量子数:0、1、2和3。n = 4的子级总数为n或4:4 s, 4 p、4 d而且4 f。
例子问题2:量子数
下面哪组量子数是无效的?
n= 3
l= 2
米= 1
n= 2
l= 1
米= 0
n= 2
l= 1
米= 1
n= 3
l= 1
米= 0
n= 4
l= 2
米= 3
n= 4
l= 2
米= 3
主量子数(n)和角量子数(l)是可以接受的。然而,磁量子数(米)被限制在-之间l而且l.因此,对于l=2,唯一可能的数字米分别是-2 -1 0 1 2。