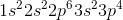例子问题
例子问题1:原子和元素
一个原子的原子核中有多少中子
从元素周期表中,我们发现原子序数,即原子核中的质子数


例子问题1:原子核
哪个原子符号表示周期为5的过渡金属形成a时有42个电子
过渡金属从第3组延伸到第12组,从第4组延伸到第7组。中性的Ru有44个电子。因此,当它变成
问题31:核、量子和分子化学
含有34个质子、36个中子和36个电子的原子的同位素的质量数、原子序数和电荷是多少?
质量数量:
原子序数:
费用:
质量数量:
原子序数:
费用:
质量数量:
原子序数:
费用:
质量数量:
原子序数:
费用:
质量数量:
原子序数:
费用:
质量数量:
原子序数:
费用:
原子序数等于元素中的质子数,所以从元素周期表中,我们发现原子序数为34的元素是硒。自

例子问题1:核力量
下列哪项将力从强到弱组织起来?
范德华力,偶极-偶极相互作用,氢键,共价键
共价键,氢键,偶极-偶极相互作用,范德华力
偶极-偶极相互作用,氢键,共价键,范德华力
范德华力,氢键,共价键,偶极-偶极相互作用
氢键,共价键,偶极-偶极相互作用,范德华力
共价键,氢键,偶极-偶极相互作用,范德华力
共价键是目前最强的,需要
接下来是氢键,氢键之间需要
接下来是偶极-偶极相互作用,它需要
最后,范德华力是所列力中最弱的,需要
问题92:物理化学
下列哪一种电子构型表示原子处于激发态?
当一个电子跃迁到较高的能级时,一个原子就被认为处于激发态。在
例子问题2:原子和元素
镁原子的完整基态电子构型是什么?
122 s22 p63 s6
122 s22 p23 s2
122 s23 s2
122 s22 p63 s2
142 p63 s2
122 s22 p63 s2
镁的原子序数是12,所以它的排布中的电子总数加起来应该是12。s亚层的最大电子数是2。在所有的答案选项中,只有122 s22 p63 s2符合的标准。指数值的和是12,与镁的原子序数,和电子数相匹配年代而且psubshell匹配可能的最大数量。
示例问题3:原子和元素
铁原子的完整基态电子构型是什么?
122 s22 p63 s23 p63 d6
122 s22 p63 s23 p64 s23 d4
122 s22 p63 s23 p64 s23 d6
122 s22 p63 s24 s23 d6
142 s22 p63 s23 p24 s23 d6
122 s22 p63 s23 p64 s23 d6
铁的原子序数是26,所以它的排布中的电子总数加起来应该是26。s亚层的最大电子数是2。指数值的和是26,与镁的原子序数,和电子数相匹配年代而且psubshell匹配可能的最大数量。
例子问题1:原子和元素
在一个原子或分子中,为什么两个电子不能有相同的四个电子量子数?
谐波反应订单
海森堡不确定性原理
泡利不相容原理
动能算符
热力学第一定律
泡利不相容原理
泡利不相容原理解释了各种现象,如原子的结构,以及不同原子如何结合共享电子。当你有两个电子在同一个轨道上,量子数n l ml都是一样的。然而,米年代将会不同。两个电子不能有相同的4个电子量子数,因为不能有超过两个电子占据一个轨道,如果它们占据了一个轨道,一个的自旋必须抵消另一个的自旋,这样它们的自旋净角动量将为零。
例子问题1:轨道和杂交
氨分子中氮原子的杂化是什么?
sp3.d
sp2
sp3.
sp
sp3.
一个原子的杂化可以由它与之成键的原子数以及它的孤对数来决定。其中两个变量是sp,三个变量是sp2,四个就是sp3..
氨中的氮与三个氢原子成键,但也有一对孤对,以满足它的八隅体。这意味着氮的表现sp3.杂化。
例子问题1:轨道和杂交
以下哪项是正确的

我都

2在一个给定的壳层中,
3

第三只
我和二世
我只
我和第三
我和第三
轨道是电子壳层中电子可能位于的区域。有几种类型的轨道,比如