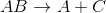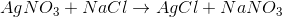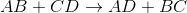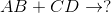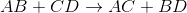例子问题
问题1:反应类型
下面哪个反应是加成反应的例子?
加成反应遵循一般模式:
当镁与氧气结合时,就会生成一种两种元素都含有的化合物。这使它成为一个简单的加成反应。一般来说,加成反应的反应物比生成物的数量要多。
其他选项对应以下反应:
分解反应:
Single-replacement反应:
Double-replacement反应:
问题2:帮助加成反应
加成反应的另一个术语是什么?
分解反应
Double-replacement反应
Single-replacement反应
合成反应
水解反应
合成反应
当两个分子结合形成一个更大的分子时,就会发生加成反应,从而释放能量。加成反应会合成一种新分子,因此它们有了第二个名字:合成反应。
许多合成反应也可以归类为脱水反应,如果水作为副产物形成的话。其中一个例子是添加氨基酸形成蛋白质链。水解反应使用水作为反应物,并用于分裂分子(分解)。
问题1:反应类型
解离反应的另一个术语是什么?
脱水反应
分解反应
Single-replacement反应
Double-replacement反应
合成反应
分解反应
当一个分子分裂成两个较小的分子时,就会发生解离反应,导致能量下降。解离反应导致大分子分解成更小的产物,因此它们有了第二个名字:分解反应。
如果用水作反应物,许多分解反应也可归类为水解反应。其中一个例子是糖原分解形成葡萄糖单体。脱水反应释放水以形成新的键,用较小的反应物生成较大的分子(合成)。
问题1:反应介绍
上面的反应可以分为__________。
单一的位移
分解
合成
分解和氧化还原
氧化还原
分解
当一个分子转化为两个或两个以上的小分子时,反应被认为是分解反应。在这个例子中,没有一个元素的氧化值发生变化,所以这不是一个氧化还原反应。(钙总是


问题3:帮助解离反应
在解离反应中,确定下列物质的潜在生成物:
解离反应通常涉及盐或离子化合物解离或分裂成其组分。在这种情况下,
包含第三种物质的选项是不正确的,因为在原始化合物中只有两种物质在解离。
问题1:电化学
下列哪个反应既包括还原反应又包括氧化反应?
氯化钠和硫酸钙的反应
单位移反应
单位移反应和氯化钠与硫酸钙的反应
既不是单位移反应,也不是氯化钠和硫酸钙的反应
单位移反应
同时具有还原半反应和氧化半反应的反应称为氧化还原反应。它包括一个或多个原子获得电子(还原)和一个或多个原子失去电子(氧化)。回想一下,单置换反应涉及用另一种元素取代化合物中的一种元素。单置换反应的例子如下:
在这个反应中,钠原子取代了硫酸钙中的钙原子。如果我们计算钠和钙的氧化值,我们可以看到钠失去了一个电子(氧化态从



氯化钠与硫酸钙的反应如下:
如果我们计算每个原子的氧化态我们会注意到氧化值没有改变;因此,这不是氧化还原反应。
问题1:反应类型
下面看到的反应类型是什么?
分解
Single-replacement
除了
Double-replacement
Double-replacement
通过观察这个反应,我们可以看到反应物中的阳离子在生成物中交换了阴离子。这意味着反应遵循一般的大纲:
这是一个双置换反应的例子。
加成反应将两种反应物转化为一种产物,而分解反应将一种反应物转化为多种产物。单次置换反应只交换一个阳离子-阴离子对。
问题2:帮助双重替代反应
如果是双置换,预测下一个反应的产物。
在双置换反应或双置换反应中,相反的离子结合。这意味着一种化合物的阳离子会重新结合并与另一种化合物的阴离子结合,反之亦然。
在这个例子中,我们必须记住在化合物中阳离子写在阴离子之前的理想惯例。所以在AB中,我们可以假设A是正离子B是阴离子。CD也是一样,C是正离子,D是阴离子。
考虑到这一点,我们现在可以很容易地看到替换是如何可能的。
如果A是一个阳离子,最初与B(阴离子)结合,那么它剩下的唯一可以结合的阴离子是D。如果C是一个阳离子,最初与D(阴离子)结合,那么它只剩下与现在自由的B阴离子结合的选择。
这就是为什么它是:
问题1:帮助氧化还原反应
可以用什么过程来描述转换

减少
燃烧
放射性衰变
中和
氧化
减少
所说明的过程是铬原子的还原。当获得电子时发生还原,导致原子的氧化数(电荷)减少。我们可以通过观察所涉及的每个原子的氧化数来检验这个过程。
氧的氧化值总是

铬的初始氧化态为
反应后,铬的电荷为

在此过程中,铬原子从氧化态变为

问题1:反应类型
确定在给定的反应中哪种化合物或离子是氧化剂。
氧化剂是使另一种元素被氧化的元素,它本身在方程式中被还原。还原被定义为电子的增益,这意味着元素会变得“更负”。
在这个反应中,铝从3+氧化态转变为0氧化态。这表示还原,因为原子获得了更多的电子并减少了电荷。