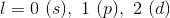例子问题
例子问题1:轨道和轨道杂化
水分子中有什么杂化轨道?
sp3.d
sp3.
sp2
sp
sp3.
分子的杂化轨道由中心原子上的原子数和孤对数决定。这两个数互相相加是为了确定键的杂化。如果有两个原子或孤对附着在中心原子上,它就会出现sp杂化。如果有三个原子或孤对连接到中心原子,它将显示sp2杂化。水有两个氢和两个孤对相连。这意味着水已经sp3.杂化。
例子问题2:轨道和轨道杂化

给定分子中碳的杂化是怎样的?
sp
sp2d
sp3.
防晒系数
sp2
sp3.
正确答案是sp3..首先剔除任何不是实际轨道的答案(例如spf完全跳过d轨道)。在此之后,使用以下指导方针来解决问题:
电子包含在具有不同名称的轨道内(S p d f)根据它们与原子核的距离。这些原子轨道离原子核越远,能量就越高。当两个原子聚在一起形成共价键时,它们最外层的轨道重叠,其中的电子被共享。两个年代原子轨道重叠时的能量更低(因此更稳定)年代和一个p轨道还是两个p轨道重叠。
与化合物相关的几何结构和每个键的强度将根据决定重叠的原子轨道而变化,但在甲烷这样的简单分子中
当确定分子中一个原子的共价键中有多少个原子轨道时,首先计算有多少个sigma(单键)键,忽略任何π(双键)键。如果有3 sigma键,那就意味着年代+p+p原子轨道结合成3sp3.杂化轨道(所以原子的杂化轨道是sp3.).我们忽略双键,因为它们是由与2的重叠形成的p原子轨道。另外,别忘了数不经常被吸进来的看不见的氢。
例子问题1:轨道和轨道杂化

箭头所指的碳的杂化轨道是什么?
sp3.df
sp3.d
sp
sp3.
sp2
sp3.
正确答案是sp3..首先,根据碳的价电子(也就是说,碳不能像碳原子那样进入能量更高的轨道),找出任何对碳没有意义的答案d或f).在此之后,您可以使用以下规则来解决问题。
杂交理论使很多人困惑。下面简要总结一下主要概念。电子包含在不同名称的轨道内(S p d f),这取决于它们与原子核的距离。这些原子轨道离原子核越远,能量就越高。当两个原子聚在一起形成共价键时,它们最外层的轨道重叠,其中的电子被共享。两个年代原子轨道重叠时的能量更低(因此更稳定)年代和一个p轨道还是两个p轨道重叠。
与化合物相关的几何结构和每个键的强度将根据决定重叠的原子轨道而变化,但在简单分子中,如甲烷(CH4)键强度都是相等的,分子几何结构相当均匀/精确。根据理论,所有参与成键的轨道都可能合并并形成新的形状,称为杂化轨道。这使得所有杂化轨道都能获得与自然界相同的能级。所以如果年代原子轨道和ap原子轨道结合,就会形成sp杂化轨道结合了这两个原子轨道的性质。
当确定分子中一个原子的共价键中有多少个原子轨道时,首先计算有多少个sigma(单键)键,忽略任何π(双键)键。如果有3 sigma键,那就意味着年代+p+p原子轨道结合成3sp3.杂化轨道(所以原子的杂化轨道是sp3.).我们忽略双键,因为它们是由与2的重叠形成的p原子轨道。还有,别忘了数不经常被吸进来的看不见的氢!!有了这些规则,你就永远不会做错杂化题。
问题4:轨道和轨道杂化

给定分子中碳的杂化是怎样的?
sp3.
sppp
sp
sp2
sp3.d
sp2
正确答案是sp2.首先剔除任何不是实际轨道的答案(例如sppp不是正确的符号,所以你可以把它作为答案选项去掉)。在此之后,你可以使用以下总结来解决这个问题:
电子包含在具有不同名称的轨道内(S p d f)根据它们与原子核的距离。这些原子轨道离原子核越远,能量就越高。当两个原子聚在一起形成共价键时,它们最外层的轨道重叠,其中的电子被共享。两个年代原子轨道重叠时的能量更低(因此更稳定)年代和一个p轨道还是两个p轨道重叠。
与化合物相关的几何结构和每个键的强度将根据决定重叠的原子轨道而变化,但在甲烷这样的简单分子中
当确定分子中一个原子的共价键中有多少个原子轨道时,首先计算有多少个sigma(单键)键,忽略任何π(双键)键。如果有3 sigma键,那就意味着年代+p+p原子轨道结合成3sp3.杂化轨道(所以原子的杂化轨道是sp3.).我们忽略双键,因为它们是由与2的重叠形成的p原子轨道。另外,别忘了数不经常被吸进来的看不见的氢。
例子问题1:轨道和轨道杂化

给定分子中碳的杂化是怎样的?
sp3.d
sdp
sp
sp2
sp3.
sp2
正确答案是sp2.首先剔除任何不是实际轨道的答案(例如sdp轨道在各自的能级上是无序的)。在此之后,使用以下指导方针来解决问题:
电子包含在具有不同名称的轨道内(S p d f)根据它们与原子核的距离。这些原子轨道离原子核越远,能量就越高。当两个原子聚在一起形成共价键时,它们最外层的轨道重叠,其中的电子被共享。两个年代原子轨道重叠时的能量更低(因此更稳定)年代和一个p轨道还是两个p轨道重叠。
与化合物相关的几何结构和每个键的强度将根据决定重叠的原子轨道而变化,但在甲烷这样的简单分子中
当确定分子中一个原子的共价键中有多少个原子轨道时,首先计算有多少个sigma(单键)键,忽略任何π(双键)键。如果有3 sigma键,那就意味着年代+p+p原子轨道结合成3sp2杂化轨道(所以原子的杂化轨道是sp2).我们忽略双键,因为它们是由与2的重叠形成的p原子轨道。另外,别忘了数不经常被吸进来的看不见的氢。
*如果现在想起来有点困惑,你可以计算:
空间数=与该原子结合的原子数+该原子上的孤对数
如果空间数是4 =sp3.,如果3 =sp2,如果2 =sp.
例子问题6:轨道和轨道杂化

注意标记的碳。这个碳的键角是多少?
正确答案是
空间数=与该原子结合的原子数+该原子上的孤对数。如果空间数是4 =sp3.,如果3 =sp2,如果2 =sp.
接下来,根据你对杂化理论的理解,你知道碳原子sp杂交分子本质上是线性的(一个常见的线性分子例子是二氧化碳)。如果碳的几何结构是线性的那就意味着它所经历的键角一定是线性的
例子问题1:轨道和杂化
能容纳多少电子
八个
十八岁
六个
十个
14
十八岁
一个
这个问题最好用量子数来解决。我们已经给出了主量子数。利用这个,我们可以计算出这个壳层能容纳多少电子。量子数的规则如下。
如果主量子数是3,那么下一个量子数可以是0、1或2。这些对应于年代,p,d分别轨道。
在那之后,下一个量子数描述了亚壳层内的轨道。根据最终的量子数,每个轨道可以携带两个电子。
总的来说,在第三能级的所有亚层中允许有18个电子。
例子问题1:电子构型
钾离子在带+1电荷后电子排布是怎样的?
[阿拉伯文]4 s23 d4
[阿拉伯文]4 s2
[阿拉伯文]4 s1
(Ne) 3 s1
[阿拉伯文]
[阿拉伯文]
钾(K)最初的电子排布是[Ar]4s1.为了获得+1电荷,它失去了一个电子,形成了[Ar]的构型。
例子问题2:电子构型
下列哪种物质可以用给定的电子排布表示?
由于过渡金属的半轨道稳定现象,电子可以很容易地在两者之间移动4 s而且3 d轨道。原子中只有一个原子,就能获得更大的稳定性4 s轨道,允许半满3 d轨道,而不是满轨道4 s轨道和四个电子3 d亚层。
对于像铬和铜这样的元素,它们的价壳结构可能是4 s23 d4而且4 s23 d9,分别得到一个电子4 s轨道跳到了3 d利用半满轨道增加稳定性。给定的电子构型是铬的电子构型。
注意,你也可以通过计算电子数来确定原子序数来解决这个问题。在这种情况下,电子加起来是24,表示第24个元素:铬。
例子问题1:电子构型
什么是正确的电子结构
这个问题问的是基态镁的电子结构,




注意,镁的基态有12个电子(与它的原子序数相同),而离子有10个。