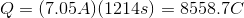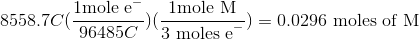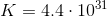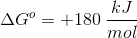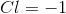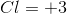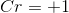例子问题
问题1:反应
假设一种化合物只含有碳、氢和氧。如果完全燃烧




注:该化合物的分子量为
要回答这个问题,记住燃烧反应的细节是很重要的。在有氧气和足够能量启动该过程的情况下,完成燃烧反应将导致初始反应物的完全氧化和分解。
的

第一步是用每个产物的质量求出原始化合物中每个元素的质量。要做到这一点,我们需要使用每个产物的摩尔质量以及单个元素。
原始化合物中碳和氢的总质量是
剩下的质量将来自氧气。因此,原始化合物将包含
一旦我们知道了每种元素的质量,我们就可以用这些信息来计算原始化合物中每种元素的摩尔数。
现在我们有了原始化合物中每种元素的相对摩尔量,我们可以通过求最小的整数比来求出实验式。
由此,我们可以得出化合物的经验质量为
最后,因为我们知道了化合物的分子量,我们可以利用这些信息来找到化合物的分子式。
问题1:反应
电解一种未知的金属氯化物,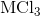
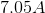
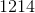
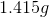
钪
铬
钛
镍
钛
首先写出这个方程来说明金属的电镀过程:
注意摩尔电子和摩尔金属的化学计量比。
接下来,回想一下下面的等式:
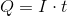



插入给定的信息查找
接下来,回想一下法拉第的电解定律,该定律将法拉第常数和电子数量等同起来,以找到沉积一摩尔特定物质所需的电荷。
因此,我们可以建立下面的公式来计算电解过程的电荷,从而计算出被镀出的未知金属的摩尔数。
现在,既然我们知道了沉积金属的克数,我们就能求出未知金属的摩尔质量。
摩尔质量表明这种金属一定是钛。
问题1:反应
钪可以在含有
装盘需要多少分钟

回想一下下面的公式:





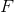
首先要找出有多少摩尔的钪被镀出来。
现在,用半反应中的化学计量比来求电子的摩尔数。
现在,用上面的公式来解时间。
现在,把秒转换成分。记住,你的答案应该只有
问题1:反应
考虑下面的氧化还原反应。
如果




在这个问题中,我们已知一个总的氧化还原反应以及相应的还原势,我们被要求解出
首先,我们可以展示每一个单独的半反应,使它更清楚。
黄金:
溴:
注意每个半反应的还原电位都是正的。这意味着对于这两种元素,它们的还原都是自发的。电压越正(或负越小),反应越自发。
从题目中给我们的问题来看,我们看到溴没有被还原,而是被氧化了。由于氧化与还原相反,还原电位的大小保持不变,但前面的符号发生了变化。因此,溴的氧化值为
为了找到总体
需要注意的一个很重要的事情是我们不需要乘以两个半反应的还原势。尽管金的还原反应需要两个化学计量当量,溴的氧化反应需要三个化学计量当量



问题1:氧化还原反应
银的标准还原电位等于
镍,其标准还原电位为
钴,其标准还原电位等于
钠的标准还原电位是
铜的标准还原电位等于
钴,其标准还原电位等于
在这个问题中,我们已知银的标准还原电位,并告诉我们银在光伏电池中充当阳极。然后我们被要求找出一种可以作为阴极的化合物。
首先,有几件事我们需要认识到。首先,我们被告知这是一个伏打电池,可以进行自发氧化还原反应。这意味着能量将从反应中释放出来,因此,细胞的总电位需要为正。
此外,阳极是发生氧化的半电池。在这种情况下,由于银作为阳极,银将被氧化。氧化过程中释放的电子将穿过导线到达阴极,释放出能量,在氧化过程中做功。一旦到达阴极,电子就会被用来还原阴极上的任何化合物。
既然我们已知银的标准还原电位,我们知道整个反应一定是自发的,我们就能确定阴极需要什么样的还原电位。记住,在电化学电池中,电池电位可以表示如下。
此外,如前所述,由于这是一个伏打电池,反应将是自发的,因此
代入for的值
这表明,阴极半电池需要有一种化合物,其标准还原电位大于银的还原电位。符合这一标准的唯一选项是钴,它的标准还原电位为
问题1:能斯特方程
考虑以下在伏打电池中进行的氧化还原反应。
如果还原电位为






对于这个问题,我们有一个发生在伏打电池中的氧化还原反应。我们还得到了反应中元素的还原势,并被要求求出在给定温度下反应的标准自由能变化和平衡常数。
回想一下,在伏打电池中,反应不消耗能量,而是产生能量。阳极是氧化发生的地方,而阴极是还原发生的地方。根据题目中给我们的反应,阳极将由固体组成
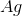




知道了这些,我们就可以计算了
现在我们有了
有几件事需要注意。的值

求的值

使用
使用
如上所示,任何一种方法都会导致我们得到相同的值
问题1:氧化还原反应
测定化合物中每个元素的氧化值
化合物中每个元素的氧化值
氯的氧化值是
因为这是中性原子,所以总电荷是0。因此我们可以
因此,
然后我们就能解出
问题1:氧化还原反应
根据下式,确定还原剂。
回想一下还原剂被氧化并失去电子。因此,在看方程式的时候,要看哪个氧化态变得更正电。
首先给元素分配氧化态。
对于反应物:







现在,确定产物的氧化态。








只有
问题1:氧化还原反应
在给定的反应中,哪些元素被氧化了?


让我们先来看看这个方程并根据已知的一般规则来分配氧化值:
让我们从反应物开始,也就是



接下来让我们看看




所以

现在我们有了反应物这边所有元素的氧化值。我建议把它们的氧化值一个接一个地写下来,这样就可以很快地确定被氧化和被还原的元素。
反应物中元素的氧化值:
现在我们来看看方程的生成物这边并确定这里元素的氧化值。首先让我们看看







最后,让我们看看



现在我们把产物中所有元素的氧化值写出来。
产品中元素的氧化值:
现在我们比较一下反应物和生成物中元素的氧化值。








问题1:分配氧化态
下面哪个化合物在a处有一个氮原子
首先,我们用已知的氧化态的基本规则逐个分析每个答案。在这个问题中最适用的规则是化合物中氢的氧化态通常等于

我们先来看看





解



不过,我们还是来看看其他情况:
因为这个化合物不带电荷我们知道它的净电荷等于
利用我们对氢和氧的氧化态的了解数一下这个化合物中氢和氧的个数,我们就能算出所有氢的总电荷等于

就像我们上面所做的那样,我们可以创建一个方程并解出未知数。
因此


接下来让我们看看
我们可以快速应用氧的氧化态知识知道化合物中氧的氧化态通常是



所以我们的方程变成了
因此

最后一个化合物是
对于这个化合物,我们可以应用我们知道的规则氢在化合物中的氧化态等于



因为有两个氮,我们的方程是:
和