例子问题
例子问题1:光电子能谱
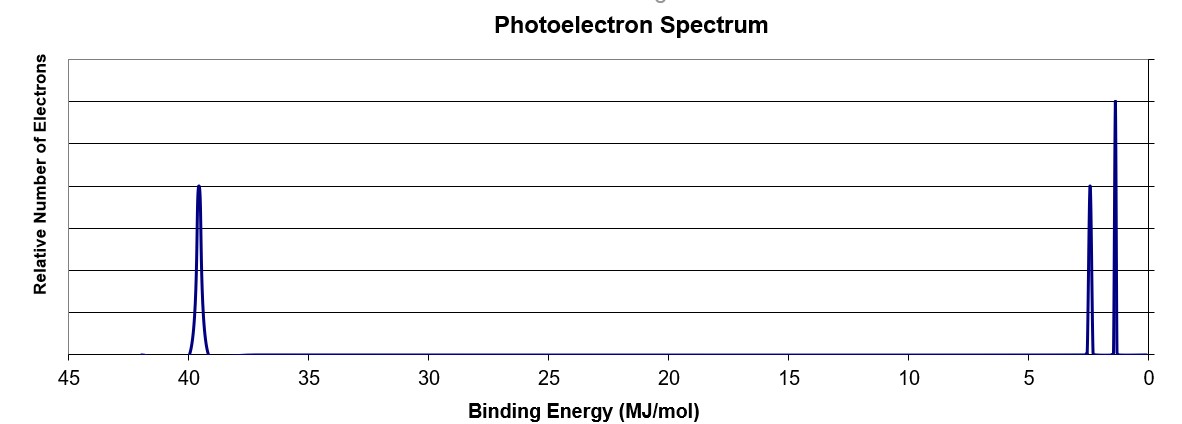
利用上述PES光谱,说明了什么元素?
C
不
N
李
Na
N
在~ 40 MJ结合能处的峰值对应于1轨道。由于在较低的结合能处有峰值,这意味着这个轨道被(2个电子)填满了。在较低的结合能处有两个峰2 s而且2 p轨道,分别。的2 s峰的强度和1峰值表明它有相同的电子数(2)2 p山峰的高度是2 s峰值,这表示轨道上有3个电子。1s轨道的电子排布22 s22 p3.等于元素N。
例子问题1:光电子能谱

利用上述PES光谱,如何解释Na和Mg之间3s峰的位置和强度的差异?
Na在3s电子上的有效核电荷更大,因此更难去除。
Na对2s和1s电子的屏蔽作用更强,使得3s电子更容易被去除。
Mg的体积更大,使得3s轨道上的电子离原子核更远,因此更容易被移走
以上都不是
Mg有更大的有效核电荷在3s轨道上有更多的电子。
Mg有更大的有效核电荷在3s轨道上有更多的电子。
Mg是Z=12, Na是Z=11。Mg中质子数的增加使有效核电荷增大。与有效核电荷较低的元素相比,这种较大的有效核电荷能使电子更紧密地结合在各自的轨道上。Mg的峰高是Na的2倍3 s轨道,因为它有两倍的电子。
例子问题1:光电子能谱

利用上面的光谱,回答以下问题:为什么氧的1s电子比氮的1s轨道更靠右?
氮比氧大,因此更容易去除1s电子。
氧有更多的电子,因此在原子中有更多的电子-电子排斥力。
氧的有效核电荷比氮的大。
在氧的2p轨道上有更大程度的电子屏蔽。
氮有3个p电子,因此没有配对,导致电子-电子排斥力较低。
氧的有效核电荷比氮的大。
氧的Z=8,氮的Z=7。与有效核电荷较低的元素相比,这种较大的有效核电荷能使电子更紧密地结合在各自的轨道上。
示例问题4:光电子能谱
利用上面的光谱,回答以下问题:上面所示元素的电子构型是什么?
在~ 53 Mj处的结合能代表1轨道。随着其他山峰的出现,这个1轨道被2个电子占据。能量较低时的峰值对应于2 s而且2 p,分别。自2 p峰是强度的两倍2 s或1年代峰值时,它有两倍的电子(4),这就得到了电子构型1s22 s22 p4.
例子问题2:原子结构与性质

利用上面的光谱,回答以下问题:从上面所示的元素中去除一个价电子所需的波长是多少(单位为m) ?
以上都不是
步骤1。将结合能从MJ/mol转换为J


步骤2:



![[Ne] 3s^2 3p^3](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/1172248/gif.latex)
![[Ne] 3s^23p^4](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/1172247/gif.latex)
![[He] 2s^2 2p^6](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/1172245/gif.latex)
![[He] 2s^22p^3](https://vt-vtwa-assets.varsitytutors.com/vt-vtwa/uploads/formula_image/image/1172246/gif.latex)










